MACROINVERTEBRADOS BENTÓNICOS DE DOS LAGOS DE ALTA MONTAÑA EN EL ESTADO DE MORELOS, MÉXICO
BENTHIC MACROINVERTEBRATES OF TWO HIGH MOUNTAIN LAKES IN THE STATE OF MORELOS, MEXICO
José Guadalupe Granados-Ramírez, Petra Barragán-Zaragoza, Roberto Trejo-Albarrán y Maribel Martínez-Alaníz
Dirección de los autores:
Laboratorio de Invertebrados, Facultad de Ciencias Biológicas; e-mail: jgranados@uaem.mx ORCID: 0000-0001-5047-4480 (J.G.G.R.), ORCID: 00000002-2836-5410 (P.B.Z.), ORCID: 0000-0003-2958-6968 (M.M.A.). Centro de Investigaciones Biológicas de la UAEM ORCID: 0000-0003-2179-1641 (R.T.A.). Av. Universidad 1001 Col. Chamilpa, Cuernavaca, Mor. México, C.P. 62210. Tel-Fax: (777) 3297047.
DOI: http://dx.doi.org/10.21676/23897864.2206
RESUMEN
Los ambientes naturales como los lagos Zempoala y Tonatiahua representan un potencial importante en la conservación de especies endémicas, además de participar en los mecanismos de regulación ecológica dentro de los lagos. El objetivo del presente fue reconocer la riqueza de macroinvertebrados bentónicos y de la zona litoral de ambos lagos, así como también actualizar el listado taxonómico de su fauna. Se realizaron cuatro muestreos en ambos lagos durante los periodos de estiaje y lluvias entre los años 2013 y 2015. Para la recolecta se utilizaron redes con poro de 500 µm de forma rectangular y en “D”. El material se preservó en alcohol al 70 % para su posterior análisis en el laboratorio de Invertebrados de la Facultad de Ciencias Biológicas de la UAEM. Para la identificación de los macroinvertebrados se utilizaron claves de identificación y literatura especializada. Los resultados fueron: para el lago Zempoala se reconocieron seis clases taxonómicas, 15 órdenes, 27 familias y 34 géneros; se registra por primera vez al isópodo Asellus sp. para estos lagos. Las familias más abundantes fueron Chironomidae, Hyallelidae, Coenagrionidae y Cambaridae. Para el lago Tonatiahua se reconocieron 16 órdenes, 41 familias y 43 géneros. Las familias más abundantes fueron Hyallelidae, Chironomidae, Cambaridae, Corixidae y el orden Sarcoptiformes.
PALABRAS CLAVE: biodiversidad; lagunas de alta montaña; grupos funcionales alimentarios; Morelos
ABSTRACT
The natural environments as Lakes Zempoala and Tonatiahua represent a significant potential in the conservation of endemic species, and participate in the mechanisms of ecological regulation within the lakes. The objective of this study was to recognize the richness of benthic macroinvertebrates and the coast area of the lakes, and to update the taxonomic list of fauna. Four samplings were conducted in both lakes during periods of dry and wet from 2013 to 2015. For collects rectangular nets were used and “D” with opening 500 µm. The material was preserved in 70 % alcohol for laboratory analysis of Invertebrates of the School of Biological Sciences UAEM. For identification of macroinvertebrates, we used keys and literature. For Lake Zempoala six taxonomic classes, 15 orders, 27 families and 34 genera; it is reported for the first time the isopod Asellus sp. for this lakes. The most abundant families were Chironomidae, Hyallelidae, Coenagrionidae and Cambaridae. For Lake Tonatiahua 16 orders, 41 families and 43 genera were recognized. The most abundant families were Hyallelidae, Chironomidae, Cambaridae, Corixidae and Sarcoptiformes order.
KEY WORDS: biodiversity; high mountain lagoons; functional feeding groups; Morelos
INTRODUCCIÓN
Los ambientes naturales como los lagos representan un potencial importante en la conservación de especies endémicas, además de participar en los mecanismos de regulación ecológica y recarga hídrica dentro de las microcuencas de las regiones de alta montaña. Los macroinvertebrados de la zona litoral y bentónica de los lagos de áreas medias y de alta montaña en México han sido poco analizados, de tal manera que su estructura poblacional y dinámica limnológica aún no han sido estudiados en su totalidad (De la LanzaEspino y García, 2002). Se calcula que más del 70 % de las especies presentes en los lagos se encuentran en la zona litoral, sublitoral y bentónica, distinguiéndose microinvertebrados y macroinvertebrados como parte fundamental de su comunidad (Boxshall y Defaye, 2008). En los ambientes lénticos, la zona litoral es la que contiene mayor número de especies de macroinvertebrados (Hanson et al., 2010), donde tienen un papel importante dentro de todos los procesos ecológicos.
Las redes energéticas alimentarias acuáticas se basan en el material autóctono producido por las algas o bien material alóctono que entra al sistema producto de los escurrimientos generados por el periodo de lluvias, siendo los macroinvertebrados un enlace importante para trasladar esta energía a diversos niveles tróficos dentro de las cadenas alimentarias. Además, controlan la productividad primaria dentro de dichos lagos consumiendo gran cantidad de algas y otros microorganismos asociados con el plancton, eliminando el tejido poco productivo (Wallace y Webster, 1996; Boxshall y Defaye, 2008). Dentro de los macroinvertebrados dulceacuícolas, se considera que menos del 5 % de todas las especies de insectos se pueden considerar acuáticas y representan el grupo más abundante y diverso en estos ambientes, mostrando una gran variedad de adaptaciones, incluyendo diferencias en sus ciclos de vida, la mayoría de estos únicamente los estadios inmaduros son acuáticos, pero algunos pasan todo o casi todo su ciclo de vida en el agua como los coleópteros Dryopidae y Lutrochidae (Archangelsky et al., 2009).
Los macroinvertebrados representan una importante fuente de alimentación para otros organismos superiores, así también tienen importancia económica, médica y actualmente son útiles para determinar la calidad del agua y la evaluación ambiental (Hanson et al., 2010). El presente estudio tiene como objetivo reconocer la comunidad de macroinvertebrados acuáticos durante los periodos de estiaje y lluvias en los lagos Zempoala y Tonatiahua ubicados en la zona de montaña del estado de Morelos y comparar la diversidad y similitud de las comunidades de los dos lagos.
MATERIALES Y MÉTODOS
Área de Estudio
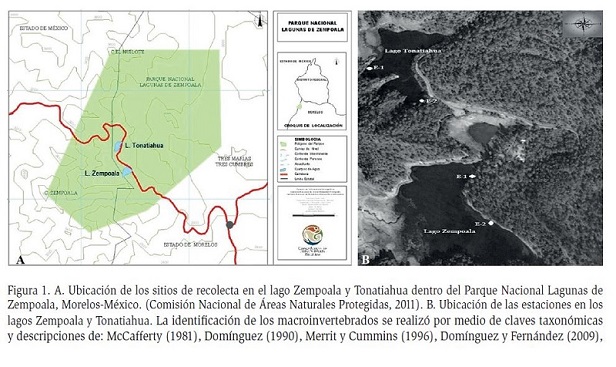
Los lagos de interés se localizan en el Parque Nacional Lagunas de Zempoala, entre los municipios de Huitzilac y Cuernavaca en el estado de Morelos y de Ocuilan en el Estado de México, comprendiendo una superficie de 4790 hectáreas (Figura 1A, 1B). El lago Zempoala se encuentra ubicado al pie del cerro Zempoala entre las coordenadas 19° 03’ 00’’ N y 99° 18’ 42’’ O, a una altitud de 2800 msnm. En términos generales, el lago se distingue por ser un ecosistema monomíctico templado, con aguas bien oxigenadas, alcalinas y mesotróficas (Trejo, 2012). El lago Tonatiahua se localiza a 200 m al oeste de los Lagos Zempoala y Compila, entre las coordenadas 19° 03’ 19’’ N y 99° 19’ 00’’ O, a una altitud de 2890 msnm. Tiene agua durante todo el año y se reporta un periodo de mezcla (García et al., 2010). Se encuentra rodeado por una combinación de suelos de tipo andosol húmico, litosol y regosol eútrico (SPP, 1979); también con aguas altamente oxigenadas, ligeramente alcalinas y en estado mesotrofico según Granados-Ramírez et al. (2014).
La recolecta de los macroinvertebrados se realizó empleando las técnicas convencionales descritas por Roldán (1996), Darrigran et al. (2007), Ramírez (2010), Springer et al. (2010) y Pardo et al. (2010), las cuales sugieren la colecta de macroinvertebrados empleando una red triangular y otra en “D” ambas con abertura de poro de 500 µm. Se realizaron recorridos de 40 m en cada estación marcada para la recolecta preservando los organismos en alcohol comercial al 70 %. La identificación de los organismos se realizó en el Laboratorio de Invertebrados de la Facultad de Ciencias Biológicas de la Universidad Autónoma del Estado de Morelos.
Thorp y Covich (2010), Springer et al. (2010) y Heckman (2006; 2011). La separación de los organismos fue por niveles taxonómicos, realizando la cuantificación para la estimación cualitativa de la abundancia por familia, género o especie por cada recolecta, y poder así aplicar los índices de diversidad de Shannon-Wiener y de similitud de Jaccard para las dos comunidades de macroinvertebrados y estimar el grado de afinidad poblacional que tienen estos lagos naturales. Los diversos métodos aplicados en la recolecta del material biológico dificultaron la comparación de los resultados obtenidos, principalmente en la interpretación de métodos estadísticos multivariados o de los indicadores biológicos.
RESULTADOS
Lago Zempoala
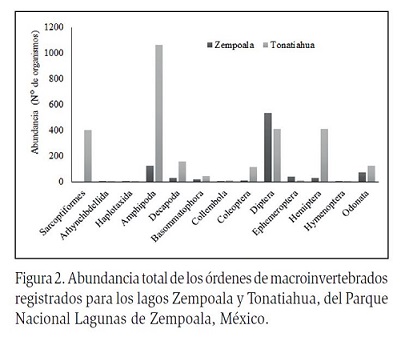
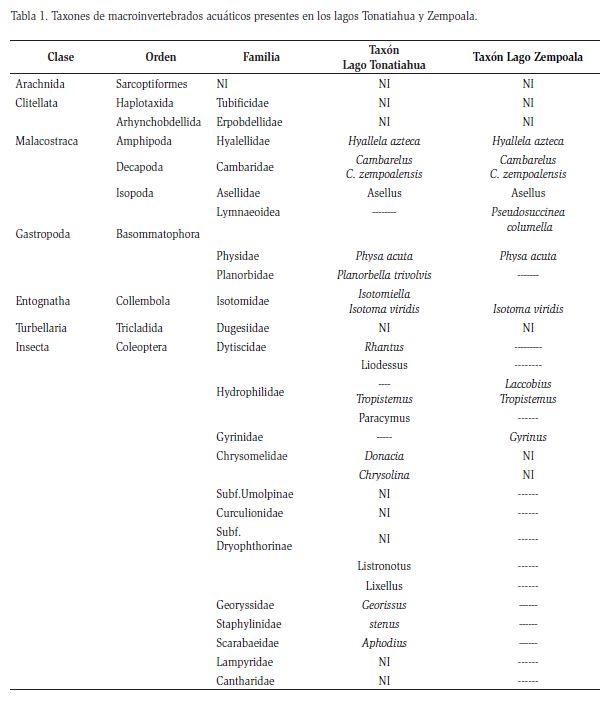
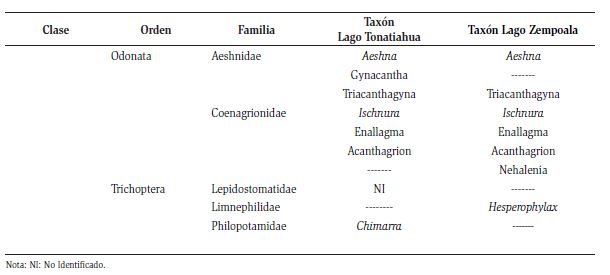
En total se reconocieron seis clases taxonómicas: Clitellata, Gastropoda, Entognatha, Insecta, Malacostraca y Turbellaria; que corresponden a 15 órdenes, 27 familias y 34 géneros (Figura 2). Las familias más abundantes durante las recolectas fueron: Chironomidae, Hyallelidae, Coenagrionidae y Cambaridae (Tabla 1).
En la época de estiaje, se identificaron 13 órdenes, 23 familias y 31 géneros. Para la clase Insecta se reconocieron 16 familias, las clases Malacostraca y Gastropoda con dos familias, mientras que Entognatha, Clitellata y Turbelaria con una sola familia. La información se ordenó según las estaciones de recolección registrando la estación 1 solo cinco órdenes de la clase Insecta: Odonata con tres familias y seis géneros, siendo éste orden el más diverso. El orden Diptera con una familia y cuatro géneros, de los cuales Cryptochironomus sp. registró mayor abundancia; Hymenoptera con dos familias, sin reconocimiento de géneros; Hemiptera con dos familias y un género cada una y Ephemeroptera con una familia y dos géneros. En la clase Malacostraca se registraron dos órdenes: Amphipoda y Decapoda, cada uno con una familia y una especie. La clase Entognatha con el orden Collembola y este con una familia y un género.

En relación a la estación 2 se identificaron cinco clases: La clase Insecta con seis órdenes, de los cuales el orden Diptera fue el más diverso con tres familias, una de ellas es Chironomidae con cuatro géneros, de los cuales Cladopelma registró mayor abundancia, Hemiptera estuvo representada por tres familias y tres géneros; Coleoptera y Odonata con dos familias y tres géneros, mientras que Trichoptera con una familia y un género. La clase Malacostraca con dos órdenes, Decapoda y Amphipoda cada uno con una familia y una especie. La clase Gastropoda presentó con un orden, Basommatophora, con dos familias y dos especies: la clase Clitellata con el orden Arhynchobdellida y la clase Turbelaria con el orden Tricladida, ambas con una sola familia.
En la época de lluvias se registraron en total 11 órdenes, 15 familias y 11 géneros. 10 familias pertenecientes a Insecta, dos a Malacostraca y una familia para Gastropoda, Turbelaria y Tricladida.
La estación 1 registró cinco clases. De la clase Insecta se reconocieron seis órdenes; Hemiptera, con tres familias y tres géneros; Coleoptera, Ephemeroptera y Odonata, con una familia y dos géneros, de los cuales el género Ischnura tuvo la mayor abundancia. Diptera con solo una familia. Malacostraca con dos órdenes, Decapoda y Amphipoda cada uno con una familia y una especie, siendo también éstas las más abundante en el periodo. Gastropoda con un orden, Basommatophora, con una familia y una especie. Las clases Clitellata con el orden Haplotaxida y la clase Turbelaria con el orden Tricladida, ambas con una familia.
Para la estación 2 se reconocieron tres clases: Insecta registró cuatro órdenes: Coleoptera, con dos familias; Hemiptera con dos familias y tres géneros, Ephemeroptera con una familia y un género, y Odonata con una familia representada por Ischnura sp. que a su vez fue el organismo más abundante del periodo de estudio. La clase Malacostraca con dos órdenes, Decapoda y Amphipoda, ambos con una familia y una especie. Finalmente, Gastropoda con un orden, Basommatophora, con una familia y una especie.
Lago Tonatiahua
En total se reconocieron seis clases: Entognatha, Malacostraca, Gastropoda, Insecta, Clitellata y Turbellaria, 16 órdenes, 41 familias, y 43 géneros (Figura 2). Las familias más abundantes fueron; Hyallelidae, Chironomidae, Cambaridae, Corixidae y el orden Sarcoptiformes.
En la época de estiaje se identificaron un total de 12 órdenes, 21 familias y 27 géneros; 14 familias pertenecientes a la clase Insecta y dos familias para las clases Crustacea, Clitellata y Gastropoda. La clase Entognatha con una sola familia.
En la estación 1 se registraron seis clases: la clase Insecta con seis ordenes; Hemiptera con cinco familias y dos géneros; Coleoptera con dos familias y tres géneros; Hymenoptera con dos familias; Odonata con dos familias y cuatro géneros; Diptera con la familia Chironomidae que registra siete géneros, de los cuales Cladopelma fue uno de los más abundantes y Ephemeroptera con una familia y un género. En la clase Malacostraca se identificaron dos órdenes: Decapoda y Amphipoda, cada uno con una familia y una especie, de las cuales Hyallela azteca fue la especie con mayor abundancia. Clitellata con dos órdenes: Haplotaxida y Arhynchobdellida y una familia identificada respectivamente. La clase Gastropoda con el orden Basommatophora registraron dos familias y dos especies. La clase Entognatha, con el orden Collembola, una familia y dos géneros.
En la estación 2 se encontraron las clases Insecta y Malacostraca. Insecta con cuatro órdenes: Hemiptera con cuatro familias y cuatro géneros; Diptera con dos familias y cuatro géneros; Odonata con dos familias y tres géneros; Ephemeroptera con una familia y un género. La clase Malacostraca al igual que en la estación 1 se identificaron las mismas especies y fue también Hyallela azteca la más abundante.
Para el periodo de lluvias se identificaron un total de 16 órdenes, 34 familias y 27 géneros; 27 familias pertenecientes a la clase Insecta, tres familias a Malacostraca y una familia para las clases Gastropoda, Clitellata, Turbellaria y Entognatha.
Estación 1: Se identificaron siete clases, donde Insecta registró siete órdenes; Coleoptera, con la mayor diversidad, con nueve familias y 12 géneros; Hemiptera con seis familias y siete géneros, de éstas, Corixidae registró mayor abundancia; Diptera e Hymenoptera con dos familias, mientras que Ephemeroptera, Odonata y Trichoptera con una familia y un género. La clase Clitellata mostró al orden Haplotaxida, la clase Turbellaria con el orden Tricladida, la clase Malacostraca con el orden Decapoda; la clase Gastropoda tuvo al orden Basommatophora y la clase Entognatha con el orden Collembola, todos con una sola familia. La clase Arachnida con el orden Sarcoptiformes, el cual registró la mayor abundancia.
Estación 2: se registraron tres clases: Insecta con siete ordenes; Hemiptera con tres familias y cuatro géneros, Odonata con dos familias y dos géneros, Trichoptera con dos familias, mientras que Diptera, Ephemeroptera, Hymenoptera y Lepidoptera con una familia. La clase Malacostraca con tres órdenes: Decapoda, Amphipoda e Isopoda, presentaron una especie al final del estudio cada orden, siendo Hyallela azteca el organismo más abundante. La clase Clitellata con el orden Haplotaxida tuvo una sola familia.
Para finalizar y con el propósito de registrar el grado de similitud y el valor de la diversidad reconocida para ambos lagos se aplicaron los índices de Diversidad de Shannon-Wiener (H´) y de Similitud de Jaccard (Ij), obteniendo los siguientes valores: para el lago Zempoala el índice de S-W fue de 2,6 bits en lluvias y 3,8 bits en estiaje; para el lago de Tonatiahua S-W fue de 2,9 bits en lluvias y de 2,4 bits en estiaje correspondiéndoles un valor en el índice de Similitud de 20,9 % en lluvias y 34,6 % en estiaje. Esto indica que los lagos aún guardan una alta riqueza específica y no comparten gran parte de su fauna de macroinvertebrados, aunque en la distribución de los grupos funcionales si se presenta una similitud proporcional entre ambas comunidades (Figuras 3a, 3b).

Se registraron seis grupos funcionales alimentarios (GFA) en ambos lagos, predominando por su elevada abundancia los colectores-filtradores en el periodo de estiaje con valores del 79 % en el lago Zempoala y el 60 % en el lago Tonatiahua, con un promedio de ocho taxones para cada ambiente estudiado. Con respecto a la abundancia se observó que los depredadores también presentaron ocho taxones como parte de este grupo funcional, con un valor del 16 % para el lago Zempoala y 30 % para el lago Tonatiahua.
Durante el periodo de lluvias en el lago Zempoala predominaron por su abundancia los depredadores (70 %), representados por cuatro taxones, seguido por los cortadores (17 %) con solo tres taxones y en tercer lugar, los colectores-filtradores con el 6 %. En el lago Tonatiahua se encontraron las mayores abundancias en los cortadores-fragmentadores (60 %), representado por cinco taxones, en segundo lugar, tenemos a los raspadores y desgarradores con el 9 % en ambos GFA (Figuras 3a, 3b).
DISCUSIÓN
De los 32 géneros registrado por Díaz (2000), Elizalde (2000) y Gutiérrez (2006) 13 géneros coinciden con la lista general de macroinvertebrados recolectados en el lago Zempoala. Por lo tanto, el presente estudio aporta un total 21 nuevos géneros al inventario faunístico del lago de Zempoala. En el presente trabajo se registró una mayor abundancia de macroinvertebrados en el periodo de estiaje, el cual coincide con los resultados obtenidos por García-Rodríguez et al. (2010) y Quiroz-Castelán et al. (2000), quienes citan un incremento importante de sus poblaciones durante las colectas realizadas en el periodo otoño - invierno, relacionando este incremento de organismos, como producto de la estabilización del ecosistema y una disponibilidad de alimento. Mientras que la reducción de las poblaciones de estos organismos en época de lluvias es causada por el mayor movimiento de la masa de agua debido al efecto de arrastre que provoca este periodo, el cual produce el aumento de la intensidad de las corrientes en el fondo lo cual provoca la inhibición de las comunidades y reduce considerablemente su tasa de crecimiento (Prejs y Prejs, 1992; Iwakuma, 1992; Jackson, 1993; Brug, 2005). Bazzanti et al. (1998) y Díaz (2000), indican que una baja riqueza los taxones en estos ecosistemas en el verano es generada por la reducción de oxígeno en toda la columna de agua, mayor actividad de los depredadores, reducción del alimento, cambios en los ciclos de vida y la migración, observando una recolonización en el lago cuando este registra una estabilidad ambiental y un incremento en la concentración del oxígeno disuelto en el agua, sucediendo principalmente estos cambios durante el otoño.
Las altas abundancias registradas difieren de lo propuesto por Brug (2005) y Quiroz-Castelán et al. (2000) quienes registraron como grupo dominante para el lago Zempoala a la subclase Oligochaeta, seguido de los quironómidos. Similares tendencias se observaron en los anfípodos, mientras los registros más bajos estuvieron en la clase Insecta. En el presente trabajo la Clase Insecta representó la mayor abundancia en el lago Zempoala, esto puede ser indicio de que este lago presenta una mayor acumulación de materia orgánica no deseada, producto de la gran actividad turística y de recreo que registra cada fin de semana el parque.
El lago Tonatiahua, al igual que el de Zempoala, presentó una mayor abundancia de organismos en el periodo de estiaje, contra una menor riqueza de familias y géneros en el periodo de lluvias, resultados similares fueron registrados por Quiroz-Castelán et al. (2000). Brug (2005) encontró que el anfípodo Hyallela azteca fue el más abundante en el estudio realizado en el lago Tonatiahua durante el periodo de sequía. Durante la época de estiaje en este mismo lago Brug (2005) registra un total de 16 familias y 18 géneros, si tomamos en cuenta los resultados previos de ambos muestreos (estiaje y lluvias), para el lago Tonatiahua tendremos en total 1órdenes, 41 familias, y 43 géneros, aportando con este trabajo a la lista general para el lago un orden más, 15 familias y 24 géneros no citados por el anterior trabajo.
En las zonas litorales de diversos lagos en Estados Unidos se registraron altas abundancias de quironómidos de acuerdo a los estudios de macroinvertebrados realizados en diversos lagos de Wisconsin (Beckett et al., 1991), Michigan (Mittelbach, 1981), Nueva Jersey (Dougherty y Morgan, 1991) y Nueva Zelanda (Weatherhead y James, 2001), todos encontraron un dominio de oligoquetos y dípteros, de éste último se destacan las altas abundancias en la familia Chironomidae. Los pocos trabajos en lagos realizados en México describen a los quironómidos como una de las familias más abundantes del zoobentos y zona litoral como es el caso de DíazPardo et al. (2002) para el lago Azteca; Alcocer et al. (2002) en el lago Valle de Santiago en Guanajuato y Torres y Pérez (2002) para el lago de Catemaco. La alta distribución de ciertos taxones de quironómidos puede deberse a su capacidad para persistir entre sustratos inestables de lagos enriquecidos por las diferentes actividades antrópicas (Weatherhead y James, 2001; Paggi, 2009). Por lo tanto, debemos de considerar que la presencia de este grupo en abundancia en los lagos nos indica un incremento de materia orgánica en el fondo.
La zona litoral del lago Zempoala se caracterizó por presentar un elevado contenido de materia orgánica con áreas donde tiende a la acidez y exhibe cantidades variantes de nutrientes, resultado del alto grado de descomposición del detritus acumulado en la orilla y el fondo del lago (Bonilla, 1992; Díaz et al., 2005; Quiroz, 2007), por lo que es común encontrar con frecuencia a los quironómidos. Bailey y Litterick (1993), en un estudio en el lago Victoria (Uganda), demostraron que la concentración de oxígeno disuelto en el agua reguló la distribución y abundancia de los macroinvertebrados principalmente Chironomidae, Oligochaeta, Hirudinea y Coleoptera ya que estos organismos toleran condiciones de bajas concentraciones de oxígeno disuelto. Aunque en algunos quironómidos del lago Tonatiahua se observó coloración verde, esto indica suficiente concentración de oxigeno tanto en la columna de agua como en el sedimento, donde tienden a vivir y construir galerías con la ayuda de secreciones corporales, sin embargo también pueden soportar condiciones de hasta 1 mg/L de acuerdo a lo registrado por Rives y Márquez (1998) y que debido a la hemoglobina de su cuerpo esto les permite capturar el oxígeno del aire.
En cuanto a la abundancia de Hyalella azteca, diversos autores han mostrado que tanto el crecimiento como el desarrollo de los anfipodos es afectado por varios factores ambientales, resaltando de manera especial la temperatura (Bovee, 1950; Cooper, 1965; De March, 1977), el fotoperiodo (Pilgrim y Burt, 1993) y la calidad del alimento (Hargrave, 1970; Moore y Farrar, 1996; Wellborn, 1994); ademas estos organismos por su tamaño se encuentran en sitios que ofertan protección contra sus depredadores (peces, aves, insectos acuáticos y anfibios), habitando principalmente entre las macrófitas de la zona litoral, algas bentónicas y el microbentos (Mathias, 1971; Alcocer et al., 2002; Peralta, 2006). Al parecer, las condiciones de los lagos fueron adecuadas, registrando a la especie en los dos periodos de estudio con relativa abundancia en ambos lagos.
En el periodo de lluvias Cambarelus zempoalensis fue también de los más abundantes, se conoce que su presencia está caracterizada por dos factores: el primer los relaciona íntimamente con el sustrato lodoso y el segundo los asocia con cuerpos de agua poco profundos y sin corrientes de agua fuertes (Hernández, 1991), observando que muy posiblemente su preferencia por el sustrato lodoso se debe al alto contenido de materia orgánica que éste llega a tener considerándose como su principal fuente de alimento (Mejía-Ortiz et al., 2003). Por otra parte, las hembras cargadas de huevos tienen preferencia por enterrarse en el lodo, ya que esto ofrece protección contra depredadores (Álvarez y Villalovos, 1997). También este grupo ha sido considerado como un componente notable de las comunidades de macroinvertebrados asociados a la presencia de vegetación sumergida y se considera que su presencia en las raíces se deba a que estos organismos migran hacia estos lugares, en busca de alimento ya que la mayoría de estas especies son omnívoras (García-Montes, 1988), registrando al acocil con bastante frecuencia en la zona litoral de ambos lagos.
A pesar de la diversidad, la abundancia y la importancia ecológica; el conocimiento que se tiene sobre la biodiversidad de los isópodos de aguas continentales es todavía escaso (McCafferty, 1981). Rocha et al. (2009) señala que los isópodos de aguas continentales mexicanas son todavía más limitados, teniendo hasta el momento descritas 49 especies, quedando grandes áreas por explorar y seguramente algunos grupos por reconocer, en este trabajo se registra por vez primera la presencia en los lagos Zempoala y Tonatiahua el género Asellus sp. (Sin: Coecidotea sp.), contribuyendo con este trabajo en la ampliación de microhábitat, de los isópodos continentales para México.
Como se puede observar la mayor riqueza de grupos fue registrada durante la época de estiaje y con menor riqueza durante el periodo de lluvias. Las familias con mayor abundancia fueron: Chironomidae, Coenagrionidae, Hyalellidae y Baetidae. Díaz (2000) registró como uno de los grupos predominantes a la familia Chironomidae dentro de la estructura bentónica del lago Zempoala.
Brug (2005), registró solo cinco gremios tróficos en la época de estiaje para el lago Tonatiahua, predominando el grupo de los depredadores (49 %). Pérez et al. (2004) encontraron como predominantes a los depredadores (32 %), en segundo lugar, los raspadores (23 %) y los recolectores con el 13 %, como los grupos tróficos más predominantes en ambientes acuáticos de “La Huasteca” mexicana. La variación de las abundancias y la predominancia de los taxones de cada uno de los GFA parecen estar relacionada con los periodos de colecta, donde la mayor cantidad de GFA presentes en el estiaje que en el periodo de lluvias. Rivera et al. (2013) consideraron que la variación de los gremios durante el año, aparte de estar relacionada con la estacionalidad, también está asociada a la disponibilidad de alimento y a la mayor cantidad de nichos disponibles en el ambiente. Son escasos los estudios que se han llevado a cabo sobre GFA de macroinvertebrados de lagos mexicanos, por lo tanto, su discusión es muy limitada.
CONCLUSIÓN
Los resultados obtenidos de la diversidad de macroinvertebrados revelan que ambos lagos presentan una riqueza importante. Sin embargo, el lago Zempoala es el que registra menor cantidad de riqueza y abundancia faunística, considerándolo como un ecosistema impactado por la alta actividad turística que tiene cada fin de semana. Mientras que el lago Tonatiahua con una estructura diferente en su comunidad, muestra una mayor riqueza de macroinvertebrados, mostró menor actividad turística y por lo consiguiente se evidencia menor aporte de materia orgánica, relacionado con un menor impacto antropogénico. Es importante monitorear y preservar estos ecosistemas naturales y más aún por las condiciones a las que están sometidos sistemáticamente ya que son parte fundamental del parque lagunas de Zempoala, dentro del estado de Morelos - México.
AGRADECIMIENTOS
El presente artículo forma parte del Proyecto global “Inventario de cuerpos de agua del estado de Morelos”, el cual se inició por el sistema sectorial SAGARPACONACYT (012-2004), el cual ha generado a la fecha 9 tesis de licenciatura y 2 tesis de posgrado. Actualmente, se continua el estudio sobre la biodiversidad acuática de ambientes lénticos y lóticos del estado de Morelos. Finalmente, agradecemos las facilidades otorgadas a la Secretaria de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación; a la Comisión Nacional de Áreas Naturales Protegidas; a la Comisión Nacional del AguaSección Rio Balsas; y a la Facultad de Ciencias Biológicas de la UAEM.
BIBLIOGRAFÍA
Alcocer, J., Escobar, E., Peralta, L. y Álvarez, F. 2002. Population structure of the macrobenthic amphipod Hyalella azteca (Crustacea: Peracarida) on the littoral zone of six crater lakes. En Escobar-Briones, E. y Álvarez, F., Editores. Modern approaches to the study of Crustacea. Kluwer, Nueva York.
Álvarez, F. y Villalovos, J. 1997. Decapoda. En: González, R. y Vogt, R.C., Editores. Historia Natural de los Tuxtlas. Instituto de Biología e Instituto de Ecología, Universidad Nacional Autónoma de México, México, D.F.
Archangelsky, M., Manzo, V., Michat, M.C. y Torres, P.L.M. 2009. Coleoptera. En: Domínguez, E. y Fernández, H.R., Editores. Macroinvertebrados bentónicos sudamericanos: (sistemática y biología). Fundación Miguel Lillo, Tucumán, Argentina.
Bailey, G. y Litterick, M.R. 1993. The Macroinvertebrates fauna of water hyacinth fringes in the Sudd Swamps (River Nile, Southern Sudan). Hydrobiologia 250: 97–103.
Bazzanti, M., Seminara, M. y Baldon, S. 1998. Assessing hypolimnetic stress in a monomictic, eutrophic lake using profundal sediment and macrobenthic characteristics. Journal of Freshwater Ecology 13: 405–412.
Beckett, D., Aartila, T. y Miller, C. 1991. Contrasts in density of benthic invertebrates between macrophyte beds and in open littoral patches in Eau Galle Lake, Wisconsin. The American Midland Naturalist 127: 77–90.
Bonilla, B.J. 1992. Flora y vegetación acuática vascular de las lagunas de Zempoala, Morelos, México. Tesis de Posgrado, Facultad de Ciencias, Universidad Nacional Autónoma de México.
Bovey, C. 1950. Some effects of temperature on the rates of embryonic, postembryonic, and adult growth in Hyalella azteca. Proceedings of the Iowa Academy of Science 57: 439–444.
Boxshall, G. y Defaye, D. 2008. Global diversity of copepods (Crustacea: Copepoda) in freshwater. Hydrobiologia 595: 195–207.
Brug, B. 2005. Caracterización de la comunidad de macroinvertebrados de la zona litoral en la época de secas en el lago Tonatiahua, Parque Nacional Lagunas de Zempoala, Morelos, México. Tesis de licenciatura, Universidad Autónoma del Estado de Morelos, México.
Cooper, E. 1965. Dynamics and production of a natural population of a freshwater amphipod Hyalella azteca. Ecological Monographs 35(4): 377–394.
Darrigran, G., Vilches, A., Legarralde, T. y Damborenea, C. 2007. Guía para el estudio de macroinvertebrados. Métodos de colecta y técnicas de fijación. División Zoología Invertebrados. Museo de La Plata, Facultad Ciencias Naturales y Museo, UNLP, La Plata, Buenos Aires, Argentina.
De la Lanza-Espino, G. y García, J. 2002. Lagos y Presas de México. AGT Editor S.A., México.
De March, E. 1977. The effects of photoperiod and temperature on the induction and termination of reproductive resting phase in the freshwater amphipod Hyalella azteca (Saussure). Canadian Journal of Zoology 55: 1595–1600.
Díaz, M. 2000. Aspectos sobre la densidad, diversidad y distribución de la fauna bentónica en el lago Zempoala, Morelos, México, en un ciclo anual (1997-98). Tesis de licenciatura, Facultad de Ciencias Biológicas, Universidad Autónoma del Estado de Morelos, México.
Díaz, M., Elizalde, E., Quiroz, H., Molina, I. y García, J. 2005. Caracterización de algunos parámetros físicoquímicos del agua y sedimento del lago “Zempoala”, Morelos, México. Acta Universitaria 15(2): 57–65.
Díaz-Pardo, E., Vázquez, G. y Guerra, M.C. 2002. Lago de Atezca. En: De la Lanza-Espino, G. y García, J., Editores. Lagos y presas de México. AGT Editor S.A., México.
Domínguez, R. 1990. Taxonomía, Protura a Homóptera, claves y diagnosis 1. Departamento de Parasitología Agrícola, Universidad Autónoma Chapingo, México.
Domínguez, E. y Fernández, H. 2009. Macroinvertebrados bentónicos sudamericanos. (sistemática y biología). Fundación Miguel Lillo, Tucumán, Argentina.
Dougherty, J. y Morgan, M. 1991. Benthic community response (primarily Chironomidae) to nutrient enrichment and alkalinization in shallow, soft water humic lakes. Hydrobiologia 215: 73–82.
García-Montes, J. 1988. Composición, distribución y estructura de las comunidades de macroinvertebrados epibénticos del sistema lagunar Alvarado, Veracruz. Tesis de Maestría, UACPyP-CCH-Universidad Nacional Autónoma de México, México.
García-Rodríguez, J., Molina, I., Díaz, M. y Quiroz, H. 2010. Componentes fitoplanctónicos y zoobentónicos en el lago Zempoala Morelos, México. Acta Univerisitaria 20(2): 23–30.
Granados-Ramírez, J.G., Gómez, J.L., Peña, B. y Martínez, M. 2014. Inventario de cuerpos de agua del estado de Morelos. Universidad Autónoma del Estado de MorelosAGT Editor S.A., México.
Gutiérrez, F. 2006. Variación espacial y temporal de los macroinvertebrados del lago Zempoala en el parque Nacional Lagunas de Zempoala, Morelos. México. Tesis de licenciatura, Facultad de Ciencias Biológicas, Universidad Autónoma del Estado de Morelos, México.
Hanson, P., Springer, M. y Ramírez, A. 2010. Introducción a los grupos de macroinvertebrados acuáticos. Revista de Biología Tropical 58(4): 3–37.
Hargrave, T. 1970. Distribution, growth, and seasonal abundance of Hyalella azteca (Amphipoda) in relation to sediment microflora. Journal of the Fisheries Research Board Canada 27: 685–699.
Heckman, W.Ch. 2006. Encyclopedia of South American Insects: Odonata-Anisoptera: Illustrated Keys to Known Families, Genera, and Species in South America. Springer, Dordrecht, Netherlands.
Heckman, W.Ch. 2011. Encyclopedia of South American Aquatic Insects: Hemiptera-Heteroptera: Illustrated keys to known families, genera and species in South America. Springer, Netherlands.
Hernández, E. 1991. Distribución y abundancia de Cambarellus zempoalensis, en relación a parámetros físicoquímicos en el Lago Zempoala, Morelos, México. Tesis Profesional, Facultad de Ciencias Biológicas, Universidad Autónoma del Estado de Morelos, México.
Iwakuma, T. 1992. Emergence of Chiromnomidae from the shallow eutrophic Lake Kasumigaura, Japan. Hydrobiologia 245: 27–40.
Jackson, A. 1993. Multivariate analysis of benthic invertebrate communities, the implication of choosing particular data standardization, measures of association, and ordination methods. Hydrobiologia 268: 9–26.
Mathias, A. 1971. Energy flow and secondary production of the amphipods Hyalella Azteca and Crangonyx richmondensis occidentalis in Marion Lake, British Columbia. Journal of the Fisheries Research Board of Canada 28: 711–726.
McCafferty, P. 1981. Aquatic Entomology. Science Books International, Boston.
Mejía-Ortiz, L., Hartnoll, R. y Viccon-Pale, A. 2003. A new stygobitic crayfish from México, Procambarus cavernicola (Decapoda: Cambaridae), with a review of cave dwelling crayfishes in México. Journal of Crustacean Biology 23: 391–401.
Merrit, R.W. y Cummins, K.W. 1996. An Introduction to the Aquatic Insects of North America. 3ª ed. Kendall/Hunt Publishing Company, USA.
Mittelbach, G. 1981. Patterns of invertebrate size and abundance in aquatic habitats. Canadian Journal of Fisheries and Aquatic Sciences 38: 896–904.
Moore, W. y Farrar, D. 1996. Effect of growth on reproduction in the freshwater amphipod, Hyalella azteca (Saussure). Hydrobiologia 328: 127–134.
Paggi, A.C. 2009. Diptera Chironomidae. En: Domínguez, E. y Fernández, H.R., Editores. Macroinvertebrados bentónicos sudamericanos (Sistemática y biología). Fundación Miguel Lillo, Tucumán, Argentina.
Pardo, I., García, L., Delgado, C., Costas, N. y Abrain, R. 2010. Protocolos de muestreo de comunidades biológicas acuáticas fluviales en el ámbito de las Confederaciones Hidrográficas del Miño-Sil y Cantábrico. Convenio entre la Universidad de Vigo y las Confederaciones Hidrográficas del Miño-Sil y Cantábrico, España.
Peralta, L. 2006. Ecología de los anfípodos (Crustacea: Amphipoda) litorales de los lagos Maars de puebla, México. Tesis de maestría, Facultad de Ciencias, División de Estudios de Posgrado, Universidad Nacional Autónoma de México, México.
Pérez, R.M., Pineda, R.F. y Campos, V. 2004. Estructura trófica de las asociaciones de macroinvertebrados acuáticos de manantiales cársticos en la Huasteca Mexicana. Revista Biológicas 6: 37-47.
Pilgrim, W. y Burt, D.B. 1993. Effect of acute pH depression on the survival of the freshwater amphipod Hyalella azteca at variable temperatures: field and laboratory Studies. Hydrobiologia 254: 91–98.
Prejs, K. y Prejs, A. 1992. Importance of predation in regulating density of meio - and macrofauna in seasonal tropical waters. Hydrobiologia 242: 77–86.
Quiroz-Castelán, H., Díaz, M., Trejo, R. y Elizalde, E. 2000. Aspectos sobre la abundancia y distribución de los principales grupos de la fauna bentónica en el Lago “Zempoala”, Morelos, México. Ciencia y Mar 10: 39–50.
Quiroz, R. 2007. Los lagos de Zempoala y Tonatiahua del Parque Nacional Lagunas de Zempoala, Morelos. En: De la Lanza-Espino, G., Editor. Las aguas interiores de México: conceptos y casos. AGT Editor S.A, México, D.F.
Ramírez, A. 2010. Métodos de recolección. Capítulo 2. Revista de Biología Tropical 58(Suppl.4): 41–50.
Rivera, J. J., Pinilla, G, Camacho, D.L. 2013. Grupos tróficos de macroinvertebrados acuáticos en un humedal urbano andino de Colombia. Acta Biológica Colombiana. 18(2):279-293.
Rives, C. y Márquez, A. 1998. El zoobentos y su relación con los sedimentos del lago Huayamilpas, Delegación Coyoacán, México, D.F. Memoria I Congreso Nacional de Limnología, Morelia, Michoacán, México.
Rocha, R.A., Alvares, F., Alcocer, J., Chávez, R. y Escobar, E. 2009. Lista anotada de los isópodos acuáticos epicontinentales de México (Crustacea: Isopoda). Revista Mexicana de Biodiversidad 80: 615–631.
Secretaría de Programación Presupuesto (SPP). 1979. Síntesis Gráfica y descriptiva. Parque Nacional Lagunas de Zempoala. Parques Nacionales. México, D. F.
Springer, M., Ramírez, A. y Hanson, P. 2010. Macroinvertebrados de agua dulce de Costa Rica I. Revista Biología Tropical 58(Suppl. 4).
Thorp, H.J. y Covich, A.P. 2010. Ecology and Classification of North American Freshwater Invertebrates. Academic Press, Boston.
Torres, O.R. y Pérez, R.A. 2002. El lago de Catemaco. En: De la Lanza, G. y García, J.L., Editores. Lagos y presas de México. AGT Editor, S.A., México.
Trejo, R. 2012. Variación del zooplancton en el lago Zempoala, Morelos México. Tesis de Maestría, Facultad de Ciencias, Universidad Nacional Autónoma de México.
Wallace, J. y Webster J. 1996. The role of macroinvertebrates in stream ecosystem function. Annual Review of Entomology 41: 115–139.
Weatherhead, M. y James, R. 2001. Distribution of macroinvertebrates in relation to physical and biological variables in the littoral zone of nine New Zealand lakes. Hydrobiologia 462: 115–129.
Wellborn, A. 1994. Size-biased predation and the evolution of prey life histories: a comparative study of freshwater amphipod populations. Ecology 75: 2104–2117.
Fecha de Recibido: 18/02/2016
Fecha de Aceptación: 13/06/2017
Fecha de Aceptación: 22/06/2017
Para citar este artículo: Granados-Ramírez, J.G., Barragán-Zaragoza, P., Trejo-Albarrán, R. y Martínez-Alaníz, M. 2017. Macroinvertebrados bentónicos de dos lagos de alta montaña en el Estado de Morelos, México. Revista Intropica Vol. 12(1): 41 - 53. DOI: http://dx.doi.org/10.21676/23897864.2206.





