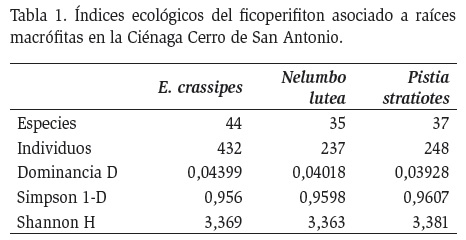
Los índices ecológicos analizados para el ficoperifiton asociado a raíces de macrófitas, mostraron poca diferencia en cuanto a la diversidad de especies en cada macrófita, de esta manera N. lutea presentó un valor de diversidad de 3,32 bit/ind, superior a E. crassipes y P. stratiotes que presentaron valores de 3,28 bit/ind y 3,24 bit/ind respectivamente.
En lo que respecta a la riqueza, E. crassipes presentó el mayor valor con 41 especies, seguido por N. lutea y P. stratiotes quienes presentaron 33 especies cada una. Por otra parte, el índice de dominancia de Simpson, mostró valores de 0,95 para las tres especies de macrófitas (Tabla 1).
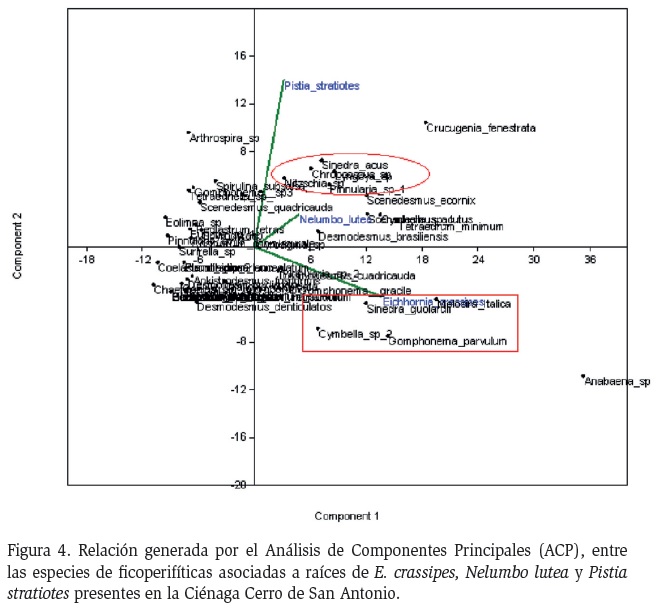
En la figura 4, el análisis de componentes principales (ACP), se relacionan las especies de microalgas perifíticas con las especies de macrófitas dominantes de la zona, (con varianza del primer componente de 77,61 %; del segundo componente de 14,86 % y del tercer componente con 7,51 %). Se encontraron diferencias en cuanto a la composición y la abundancia de especies. Las macrófitas Pistia stratiotes y Nelumbo lutea, fueron similares en cuanto a la composición de ficoperifiton, lo cual se relacionó con la presencia de Desmodesmus brasiliensis, Nitzschia sp., Synedra acus, Chroococcus sp., Pinnularia sp. (Figura 4). Mientras E. crassipes mostró diferencias marcadas, dadas por las especies Synedra guolardii, Melosira itálica, Gomphonema parvulum y Cymbella sp2. (Figura 4).
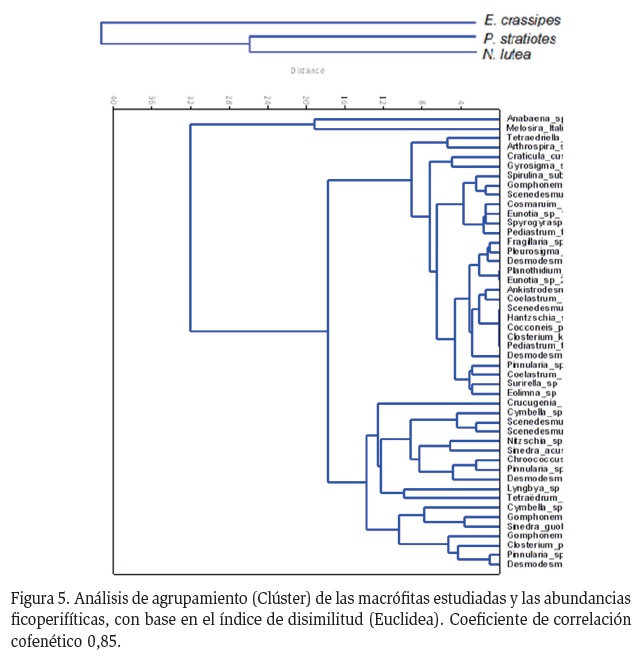
El análisis de Cluster mostró el proceso de ordenación de las abundancias de las especies ficoperifíticas con las macrófitas estudiadas, el coeficiente de correlación cofenético fue de 0,85 (Figura 5), este valor fue alto e indica que las distancias en el dendrograma reflejan eficientemente las distancias evaluadas (verdaderas), entre todos datos que se clasificaron. El ordenamiento generó tres subgrupos claramente diferenciados, cada grupo correspondió a una macrófita, así, el primer subgrupo (E. crassipes), fue el de mayor disimilitud, la diferencia estuvo dada en las altas abundancias de las especies Anabaena sp. y Melosira italica. El segundo y tercer subgrupos (P. stratiotes y N. lutea respectivamente), presentaron mayor afinidad con relación a la composición de especies ficoperifíticas, sin embargo, se diferencian en las abundancias relativas por especie, por lo que se les puede considerar grupos próximos, o con composición de algas muy similar.
DISCUSIÓN
En esta investigación se registraron 48 especies ficoperifíticas, cinco más que las encontradas por Montoya y Aguirre (2008), en el complejo cenagoso de Ayapel (Córdoba), en donde evaluaron el ficoperifiton asociado a seis macrófitas, a pesar de que la ciénaga Cerro de San Antonio presentó menor cantidad de especies de macrófitas, se evidenció una alta diversidad de ficoperifíton asociado a éstas. En términos generales la densidad total de algas perifíticas fue baja, esto sugiere una alta carga de materia orgánica y sedimentos (observada al limpiar las raíces), producto de la entrada de agua del caño Cerro de San Antonio; por otro lado, otros factores como la herbivoría, la competencia con el fitoplancton y la competencia inter e intraespecifica, también pudieron contribuir a los resultados encontrados, ya que está ampliamente demostrado que éstos, son los principales factores bióticos que regulan el crecimiento de algas del perifiton (Oliveira-Martins, 2006).
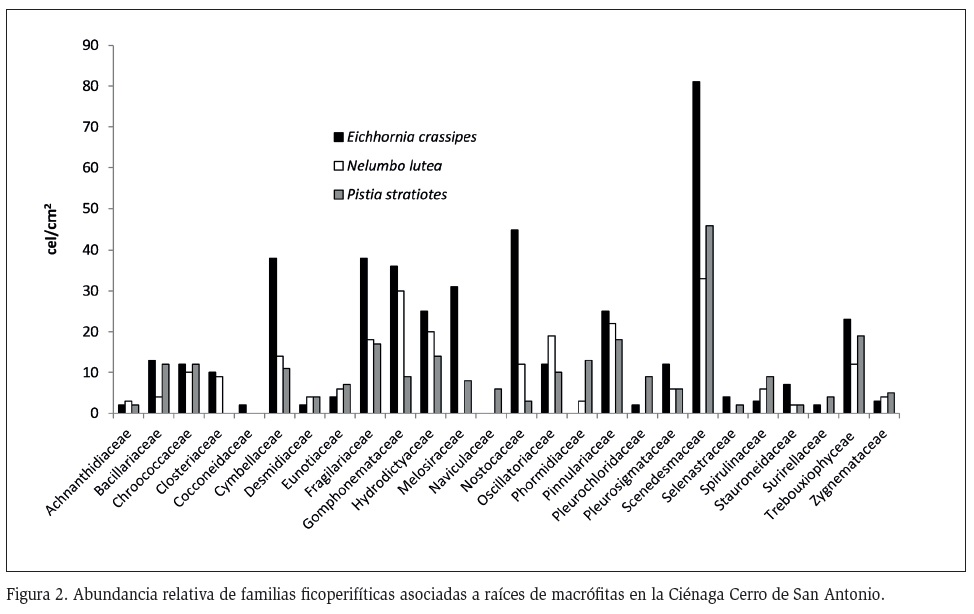
La especie E. crassipes, presentó mayor riqueza y densidad algal, valores atribuidos a que la estructura de la raíz de esta macrófita, es un rizoma de mayor envergadura y más ramificado que en P. stratiotes, a su vez P. stratiotes fue ligeramente superior a N. lutea en abundancia y riqueza de especies. Mientras que las raíces de N. lutea permanecen arraigadas al sustrato, lo que dificulta la fijación algal; P. stratiotes y E. crassipes presentan raíces, en la mayoría de los casos, flotantes en la columna de agua, lo cual puede facilitar la colonización y adherencia de algas con o sin estructuras de fijación. Montoya y Aguirre (2008), registraron para Ayapel un comportamiento similar, dos especies del género Eichhornia presentan los mayores valores de densidad ficoperifítica, en donde al igual que en esta investigación el promedio de densidad algal se incrementó de acuerdo a la complejidad estructural de la raíz sustrato (Montoya y Aguirre, 2008).
Por otro lado, E. crassipes y P. stratiotes, fueron los sustratos por los que algunas especies ficoperifíticas mostraron algún tipo de preferencia. Las especies C. kützingii, Cocconeis placentula, Hantzschia sp., P. tetras y S. meyen, presentes únicamente en las raíces de E. crassipes y las algas Eolimna sp. y C. sphaericum presentes exclusivamente en raíces de P. stratiotes, presentaron bajas densidades, por lo que no se puede determinar si existe algún tipo de agremiación microalga-macrófita. A su vez, algunas de estas especies son de hábito planctónico por lo que su presencia en el sustrato puede ser accidental y deberse a la polimixis del sistema, como lo documentaron Montoya y Aguirre (2013a), en la ciénaga de Ayapel.
Las diatomeas fueron la clase dominante, esta dominancia se debe a que este grupo presenta gran flexibilidad ecológica lo que les permite colonizar diversos nichos y alcanzar una amplia diversificación, estando presentes en ambientes con diferentes niveles tróficos (Margalef, 1983). Algunas diatomeas tienen estructuras especializadas para fijarse al sustrato, como pedúnculos mucilaginosos (Ej. Gomphonema), secreción y producción de una matriz mucilaginosa (Ej. Cymbella, Frustulia y Navicula) y formas con ramas o pedúnculos que permiten la formación de colonias fijas al sustrato como en Eunotia y Fragillaria (Montoya y Aguirre, 2013a). Los altos valores de abundancia y riqueza de especies de estos géneros, podrían estar relacionados con la presencia de estructuras especializadas que les permiten competir con ventaja, sobre otras especies en condiciones ambientales estresantes, impuestas por la velocidad de la corriente y las descargas de contaminantes (Rodríguez y Bicudo, 2001).
Se encontraron géneros de algas verdes (clorofíceas), de habito plantónico presentes en el ensamble ficoperifítico (Pediastrum, Desmodesmus, Spyrogira, Cosmarium, entre otros), comunes de aguas mesotróficas a oligotróficas (Ramírez, 2000). Su presencia se debe a lo poco profundo del ecosistema y a la acción del viento que mezcla continuamente el agua, lo cual pudo arrastrar a estos organismos plantónicos a la matriz perifítica en donde son embebidos con facilidad. En estudios de perifiton de ambientes lénticos, embalses y sistemas acuáticos como humedales, es común encontrar que las diatomeas predominen en ensambles perifíticos; sin embargo, en las ciénagas la dominancia de las diatomeas se iguala a las clorofíceas e incluso son reemplazadas en el dominio del ensamble, como ocurre en ecosistemas en el Chocó (Montoya-Moreno y Aguirre, 2013b). De acuerdo con los datos registrados en la Ciénaga Cerro de San Antonio, las diatomeas comparten dominancia con las clorofíceas, aunque por las altas densidades registradas para algunas especies de clorofíceas, la tendencia es que éstas se vean favorecidas y dominen por completo la comunidad.
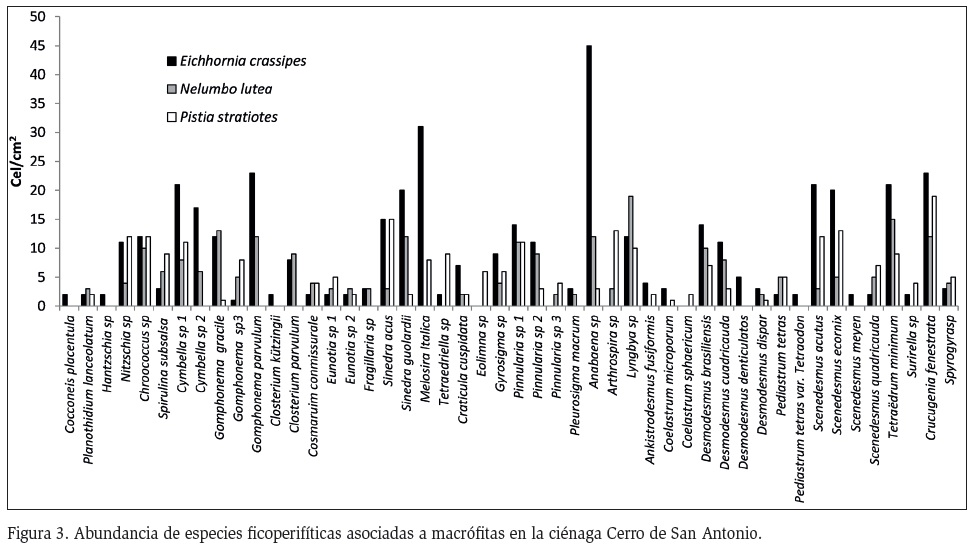
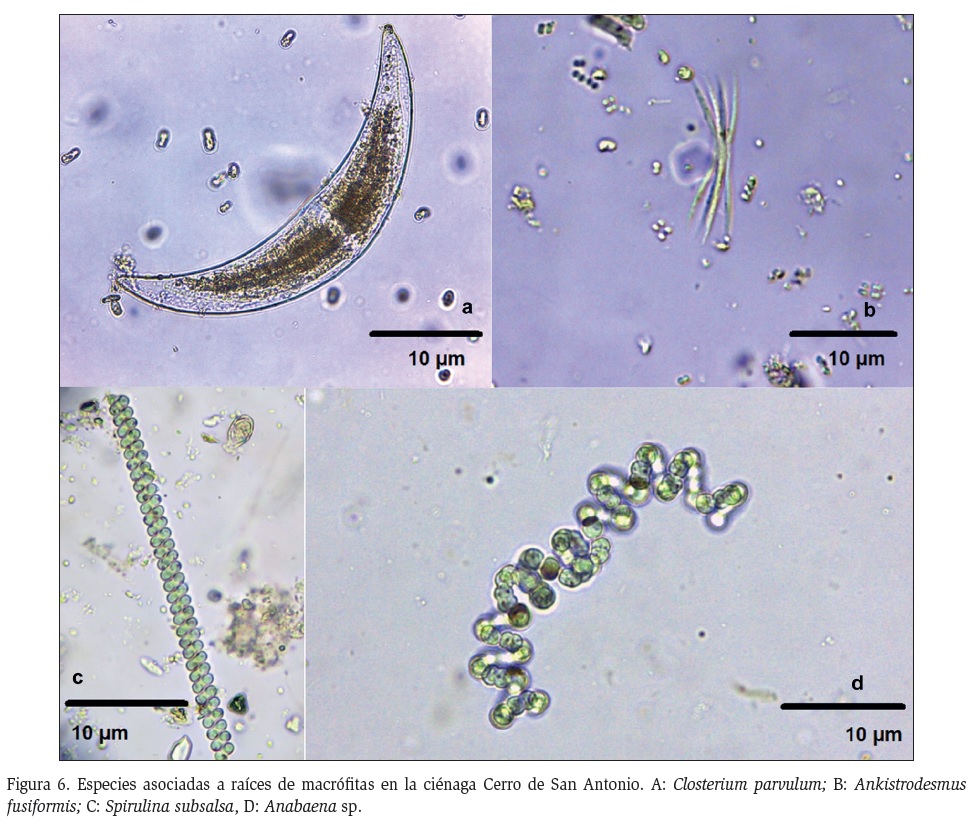
La especie Ankistrodesmus fusiformis (Figura 6B), es de hábitat planctónico y cosmopolita (Ramos et al., 2012) y está presente en lagos dulceacuícolas o asociado a vegetación del litoral. El registro de esta especie representa el primero para las ciénagas del departamento del Magdalena. Como la mayoría de especies registrada, A. fusiformis prefiere aguas poco ácidas y no contaminadas y son sensibles a los herbicidas (Echenique et al., 2004).
El género Closterium (Figura 6A) es cosmopolita, está presente en el perifiton de lagos y lagunas oligotróficas ácidas; rara vez en aguas alcalinas y ambientes eutróficos (Guiry, 2015). Las especies de este género son particularmente resistentes a los desechos ricos en cromo y cuando su densidad es alta, pueden conferirle olor a pepino al agua (Ramírez, 2000).
Dentro de las cianofíceas, la especie Anabaena sp. (Figura 6D), presentó valores significativos de abundancia, en las tres macrófitas evaluadas; resultado esperado debido a que es una especie común de aguas estancadas en donde se encuentra formando parte del plancton (De la Lanza et al., 2000). Esta Cyanophyceae, es capaz de detectar de forma general cualquier tipo de elemento ambiental perjudicial que le suponga una destrucción en su actividad metabólica, el cual se traduce en una disminución de la emisión de luz del organismo, lo que se utiliza como indicador de toxicidad ambiental (De la Lanza et al., 2000). Dicha propiedad luminiscente, se emplea de forma rutinaria para la medida rápida de toxicidad de muestras ambientales de toda índole (aguas fluviales, efluentes de depuradoras, aguas marinas, subterráneas, suelos, etc., De la Lanza et al., 2000).
La cianofícea Spirulina subsalsa (Figura 6C), es cosmopolita y de amplia distribución (Guiry, 2015). Habitualmente se encuentra de manera solitaria, mezclada con otras algas, en diversos ambientes, que abarcan desde aguas dulces o salinas hasta humedales costeros, en los que vive de manera planctónica y bentónica. No suele formar poblaciones abundantes. Fue registrada en 1996 en la Ciénaga Grande de Santa Marta (CGSM), sin embargo no se proporcionan registros fotográficos (Vidal, 2010).
CONCLUSIONES
La caracterización del ensamble ficoperifítico, dio como resultado la co-dominancia de las diatomeas y clorofíceas, en todos los sustratos evaluados, por lo general las diatomeas predominan en este tipo de ambientes ya que presentan estructuras y adaptaciones
para la fijación al sustrato (pedúnculos, ganchos, sustancias mucilaginosas), sin embargo la presencia en altas densidades de clorofíceas, puede indicar que esta ciénaga recibe una carga orgánica elevada (evidenciada al limpiar las raíces) y una penetración lumínica permanente a lo largo de todo el año que favorece su crecimiento.
En el ensamble ficoperifítico estudiado son más notorias las diferencias en cuanto a la densidad de algas de cada sustrato particular. Sólo E. crassipes y P. stratiotes presentaron especies exclusivas, sin embargo, el muestreo realizado no es suficientemente representativo para afirmar que la selectividad por el sustrato de algunas especies de algas, se deba a algún tipo de agremiación microalga-macrófita.
AGRADECIMIENTOS
Este estudio fue realizado en el marco del proyecto INVESTIGACIÓN PARA LA CARACTERIZACIÓN, ZONIFICACIÓN, ORDENAMIENTO, RESTAURACIÓN Y MANEJO DE CIÉNAGAS DEPARTAMENTO DEL MAGDALENA, CARIBE. Código BPIN: 2013000100017, financiado bajo el Convenio de cooperación 096/2013 entre la Fundación para la Participación; Capacitación y la Investigación Social “FUPARCIS” y la Gobernación del Magdalena.
BIBLIOGRAFÍA
Bicudo, E.M. y Menezes, M. 2006 Gêneros de algas de águas continentais. do Brasil (Chave de identificação e descrições). 2 Ed. RiMa Editora, São Carlos, Brasil.
Bourrelly, P. 1970. Les algues d`eau douce. N. Boubée y Cie. Paris.
Bourrelly, P. 1972. Les algues d`eau douce. N. Boubée y Cie. Paris.
Bourrelly, P. 1981. Les algues d`eau douce. N. Boubée y Cie. Paris.
CEN/TC 230. 2002. Water quality-Guidance standard for the routine sampling and pretreatment of benthic diatoms from rivers. European Standard. Standard references.
Echenique, R.O., Núñez-Avellaneda, M. y Duque, S.R. 2004. Chlorococcales de la Amazonia colombiana I: Chlorellaceae y Scenedesmaceae. Revista Caldasia 26(1): 37-51.
De la Lanza G.S., Pulido, H. y Carvajal, J.L.P. 2000. Organismos indicadores de la calidad del agua y de la contaminación (bioindicadores). Plaza y Valdez / Comisión Nacional del Agua, SEMARNAP/Instituto de Biología, UNAM, México, D.F.
Flynn, N.J., Snooka, D.L., Wadea, A.J. y Jarvieb, H.P. 2002. Macrophyte and periphyton dynamics in a UK Cretaceous chalk stream: the River Kennet, a tributary of the Thames. Science of the Total Environment 282-283: 143-57.
Guiry, M.D. 2015. AlgaeBase. World-wide electronic publication, National University of Ireland, Galway. http:// www.algaebase.org. Consultado: 26 de Noviembre 2015.
Hauer, F.R. y Lamberti, G.A. (Eds). 2007. Methods in stream ecology. Academic Press. San Diego.
Hernández–Atilano, E.N., Aguirre, J. y Palacio, J.A. 2005. Variación espacio–temporal de la estructura de la comunidad de algas perifíticas en la microcuenca de la quebrada la vega, municipio de San
Roque (Antioquia), Colombia. Actualidades Biológicas 27(82): 67–77.
Krammer, K. y Lange-Bertalot, H. 1986. Bacillariophyceae. In: Verfasser, Herausgeber y Mollenhauer. Süsswasserflora von Mittleuropa. Band 1, Teil. Naviculaceae. Jena: Gustav Fisher Verlag.
Krammer, K. y Lange-Bertalot, H. 1988. 2/2 BacIllariophyceae. 2. Teil: Bacillariaceae, Epithemiaceae, Surirellaceae. In: Ettl, H., Gerloff, J., Heyning, H. y Mollenhauer, D. (Eds). Süßwasserflora von
Mitteleuropa. Stuttgart. Gustav Fischer Verlag.
Krammer, K. y Lange-Bertalot, H. 1991. 2/3 BacIllariophyceae. 2. Teil: Centrales, Fragilariaceae, Eunotiaceae. In: Ettl, H., Gerloff, J., Heyning, H. y Mollenhauer, D. (Eds). Süßwasserflora von
Mitteleuropa. Stuttgart, Gustav Fischer Verlag.
Lange-Bertalot, H. 2001. Diatoms of Europe. Diatoms of the European Inland Waters and Comparable Habitats. Navicula sensu stricto 10 Genera separated from Navicula sensu lato. Frustulia. Ruggell: Koeltz Scientific Books.
Margalef, R. 1983. Limnología. 1st edition. Omega. Barcelona.
McCormick, P.V. y Stevenson, R.J. 1998. Periphyton as a tool for ecological assessment and management in the Florida Everglades. Journal Phycology 34: 726-733.
Montoya-Moreno, Y. y Aguirre-Ramírez, N. 2008. Asociación de algas perifíticas en raíces de macrófitas en una ciénaga tropical Colombiana. Hidrobiológica 18(3): 189-198.
Montoya-Moreno, Y. y Aguirre, N. 2009. Estado del arte de la limnología de lagos de planos inundables (ciénagas) en Colombia. Revista Gestión y Ambiente 12(3): 85-106.
Montoya-Moreno, Y. y Aguirre, N. 2013a. Dinámica del ensamblaje algal epifítico en el sistema de planos inundables de Ayapel a través del pulso de inundación. Revista U.D.C.A Actualidad y Divulgación Científica 16(2): 491-500.
Montoya-Moreno, Y. y Aguirre, N. 2013b. Estado de arte del conocimiento sobre perifíton en Colombia. Revista Gestión y Ambiente 16(3): 91-117.
Montoya-Moreno, Y. y Ramírez, J.J. 2007. Variación estructural de la comunidad perifítica colonizadora de sustratos artificiales en la zona de ritral del río Medellín, Colombia. Revista de Biología Tropical 55(2): 585–593.
Oliveira-Martins, F. 2006. Respostas ecofisiologicas da comunidade perifitica in situ a diferentes condicoes ambientais no Rio Santa da Vitoria. Es. Tesis doctoral. Universidade Federal Do Espiritu Santo.
Ramírez, J. 2000. Fitoplancton de agua dulce: aspectos ecológicos, taxonómicos y sanitarios. Tesis de Maestría, Universidad de Antioquia, Medellín, Colombia.
Ramos, G.J.P., Bicudo, C.E. de M., Góes-Neto, A. y Moura, C.W. do N. 2012. Monoraphidium and Ankistrodesmus (Chlorophyceae, Chlorophyta) from Pantanal dos
Marimbus, Chapada Diamantina, Bahia State, Brazil. Hoehnea 39(3): 421-434.
Rivera, C. y Donato, J. 2008. Influencia de las variaciones hidrológicas y químicas sobre la diversidad de diatomeas bénticas. En: Donato, J., Editor. Ecología de un rio de montaña de los Andes colombianos (Rio Tota, Boyacá- Colombia). Universidad Nacional de Colombia, Bogotá D.C.
Rodríguez, L. y Bicudo, D. 2001. Similarity among periphyton algal communities in a lentic-lotic gradient of the upper Paraná River floodplain, Brazil. Revista Brasilera de Botánica 3: 235-48.
Sand-Jensen, K. 1983. Physical and chemical parameters regulating growth of Periphytic communities. En: Wetzel, R.G. Editor. Periphyton of Freshwater Ecosystems. Boston.
Sierra, O. y Ramírez, J.J. 2000. Variación espacio–temporal de biopelículas en la represa La Fe, el Retiro, Antioquia (Colombia). Actualidades Biológicas 22(73): 153–168.
Vidal, L.A. 2010. Manual de fitoplancton hallado en la Ciénaga grande de Santa Marta y cuerpos de agua aledaños. Fundación universitaria de Bogotá Jorge Tadeo Lozano.
Wilby, R., Cranston, L.E. y Darby, E.J. 1998. Factors governing macrophyte status in Hampshire chalk streams: implications for catchment management. Water and Environment Journal 12: 179-87.
Fecha de recepción: 31/08/2015
Fecha de aceptación: 23/11/2015
Para citar este artículo: Osorio-Ávila, F. y G. Manjarres-García. 2015. Ficoperifiton asociado a macrófitas en la ciénaga Cerro de San Antonio, Magdalena-Colombia. Intropica Vol. 10: 74 - 83