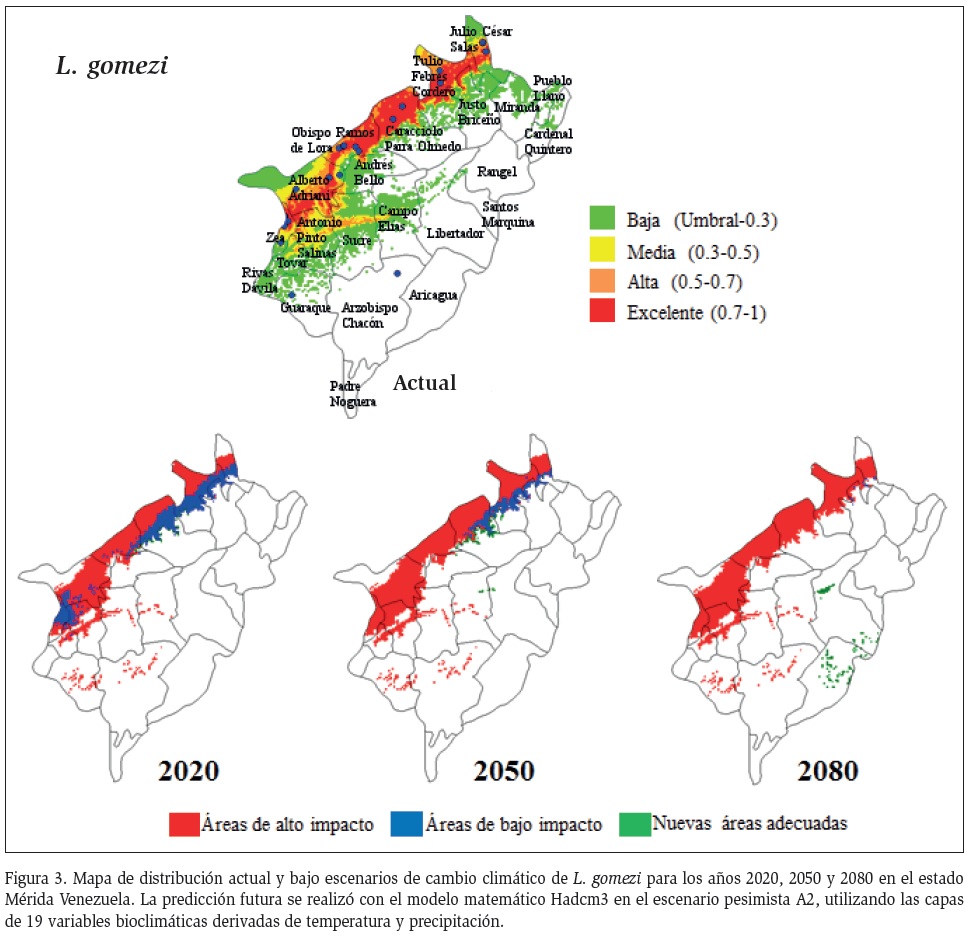
El umbral para L. gomezi, mostró una restricción del área de distribución en el futuro, el umbral de distribución actual fue menor de 0,097, con relación al escenario de cambio climático que fue de 0,145, se muestra una pequeña disminución en su distribución en la zona Panamericana y áreas del Valle del Mocotíes, para la proyección para el año 2020, para el año 2050 esa distribución se mantiene y gana espacio en pequeñas zonas de la zona Panamericana y de los municipios más poblados, mientras que en el año 2080 se consolidaría
su distribución a áreas bajas y calientes de la zona Panamericana y del Valle del Mocotíes (Figura 3).
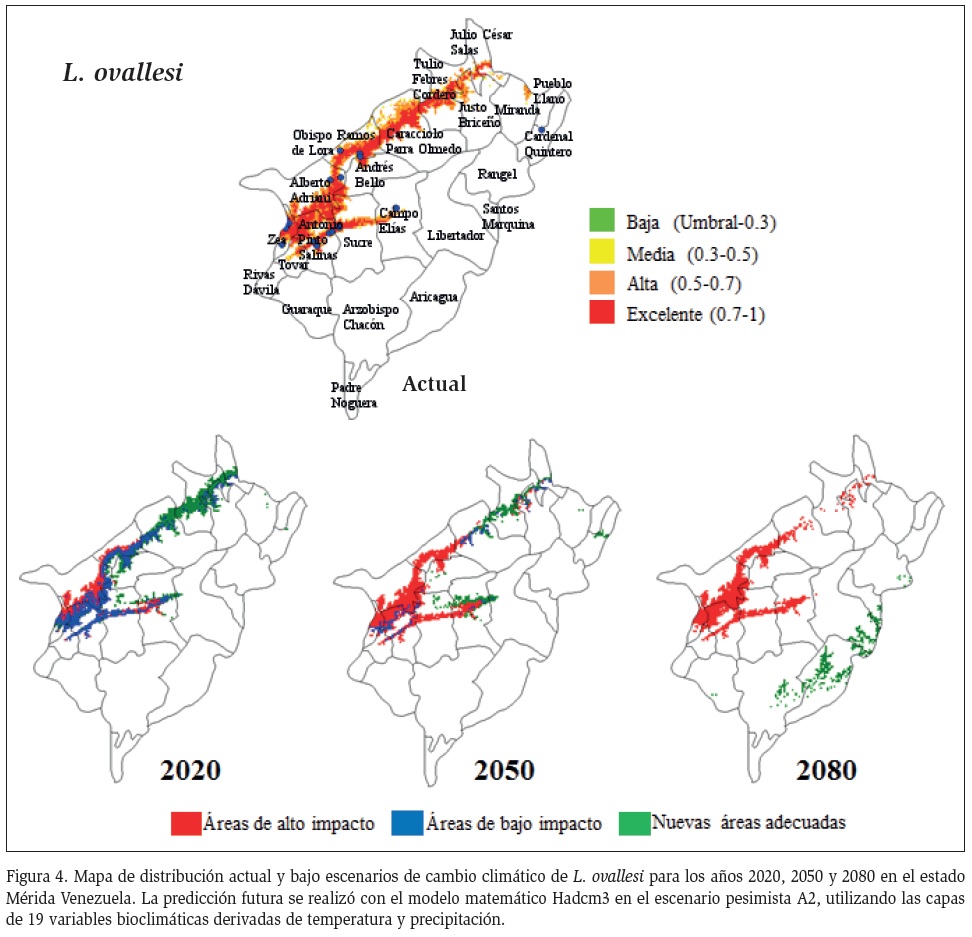
El umbral que limita el área de distribución actual de L. ovallesi fue de 0,515 y bajo el escenario de cambio climático de 0,493. Estos valores similares indican que el área de distribución potencial de la especie, en escenario de cambio climático, tendría poca expansión en su área de distribución futura (Figura 4). Esta especie es la más susceptible en el futuro a cambios climáticos, con una disminución de su distribución para el año 2020, las proyecciones para el año 2050 la distribución en las áreas actuales se va a modificar extendiéndose a nuevas áreas en la zona Panamericana
e incluso en zonas de los municipios de Sucre, Campo Elías y Libertador y para el año 2080 la distribución estará restringida a nuevas áreas de expansión de los Pueblos del Sur.
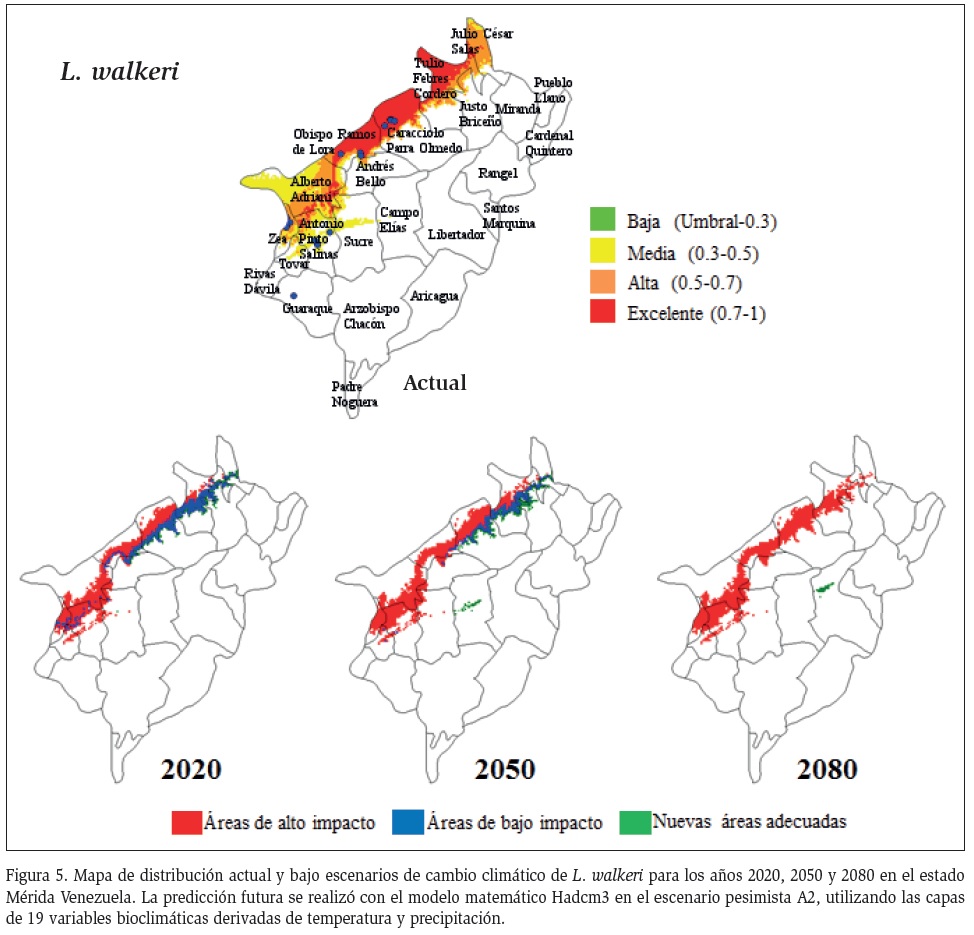
El umbral que limita el área de distribución actual y bajo el escenario de cambio climático para L. walkeri mostró valores similares de 0,409, por lo cual se entiende que la distribución potencial de la especies
bajo escenario de cambio climático se mantendrá igual a la actual para los años 2020 y 2050 y con la ocupación de nuevas áreas en el municipio Libertador para el año 2080 (Figura 5).
DISCUSIÓN
Profundos cambios ocasionados por la destrucción de los ecosistemas por fenómenos naturales o producidos por los humanos, tales como, inundaciones, deforestaciones, cambios en los patrones de la vegetación, ha causado que los ciclos de transmisión de las leishmaniasis tengan igual impacto; mientras unas especies de flebotominos desaparecen otras se tornan más abundantes o se adaptan a los ambientes sinantrópicos, modificando su conducta (Días et al., 2003; Peterson y Shaw, 2003; Nieves et al., 2014b). Recientemente, la velocidad con
la que ocurre el incremento de la temperatura, ha generado riesgos biológicos nunca antes vistos (Kuhn, 1999; Fischer et al., 2011). Los resultados del presente trabajo son realmente alarmantes ya que el cambio climático influiría en la distribución de los flebotominos en el estado Mérida, con un posible incremento en el riesgo de transmisión de la leishmaniasis. Aunque, Rodríguez et al. (2007), sugieren que los cambios en las condiciones ecológicas y climáticas, ocurridos en los últimos años en Mérida, debido a fenómenos como la vaguada y el consecuente deslave, ocurrido en las zonas adyacentes a la cuenca del río Mocotíes, pueden haber afectado la ocurrencia de casos de leishmaniasis, ya que se presentó una disminución de casos en los últimos años, este hecho pudo deberse a la disminución de transmisores, diezmados por la alteración de las condiciones ambientales, tal como ocurre, después del fenómeno de La Niña, donde se ha observado una disminución de enfermedades transmitidas por vectores (Cabaniel et al., 2005; Pabón y Nicholls, 2005; Cárdenas et al., 2006).
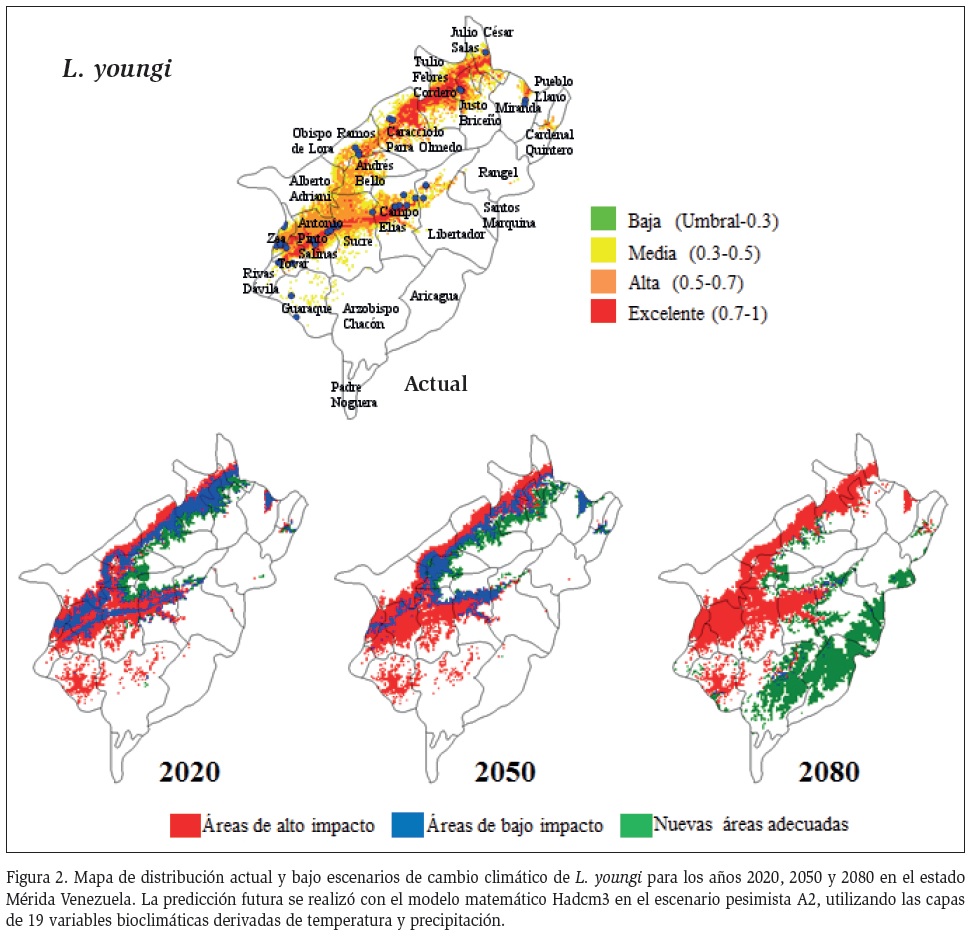
Por el contrario, las proyecciones a futuro bajo escenarios de cambio climático, con un incremento de la temperatura, muestran que para los años 2020, 2050 y 2080, que tendrían un efecto individual por cada especie transmisora. Así, como cada especie tiene un particular impacto en la transmisión de la leishmaniasis (Donalisio et al., 2012), por ejemplo L. youngi presentaría, en el futuro inmediato, un aumento en su distribución. Previa evaluación sobre la flebotomofauna en el estado Mérida, se registraron 35 especies de Lutzomyia, de las cuales 10 son consideradas antropofílicas y L. youngi considerada la principal especie transmisora y con mayor abundancia en localidades altas del estado, ubicadas entre los 800 y 1000 m (Rondón, 2015).
Los resultados predicen que L. youngi ganaría nuevos espacios de mayor altitud en el estado Mérida, producto al cambio climático, lo cual podría aumentar el riesgo de transmisión. Este hecho concuerda con modelos matemáticos que predicen que un aumento en la temperatura produciría un incremento en la abundancia de Phlebotomus perfiliewi, en toda Italia y la posibilidad de extender su distribución hacia el sur y el norte de Europa (Fischer et al., 2011). Igualmente se predice que Phlebotomus perniciosus Newstead, 1911 se extendería hacia Suiza en un ambiente más cálido (López y Molina, 2005). También, se ha previsto que en un aumento de la temperatura entre 1-5 °C, pudiesen provocar la expansión de la distribución geográfica de Phlebotomus papatasi Scopoli, 1786, al suroeste de Asia (Cross et al., 1996), incluso una expansión en la distribución para las especies de Lutzomyia anthophora Addis, 1945, Lutzomyia diabólica Hall, 1936, Lutzomyia shannoni Dyar, 1929 y Lutzomyia cruciata Coquillett, 1907 en México y Estados Unidos (González et al., 2010; Moo et al., 2013; Peterson y Shaw, 2003).
Por otro lado, Rondón (2015) registró a L. gomezi, como la principal especie transmisora y predominante en los municipios de la zona Panamericana, que corresponde a los municipios con menor altura y mayor temperatura.
Los resultados sobre cambio climático predicen en un futuro inmediato que el aumento de temperatura provocaría la pérdida de espacios para L. gomezi en la zona Panamericana y se desplazaría hacia zonas más adecuadas del Valle del Mocotíes, con la ocupación de nuevos espacios en los municipios de los Pueblos del Sur y Libertador. El cambio en la distribución implica que ésta especie podría tener la capacidad de adaptarse o de migrar. La adaptación dependerá de la conservación de la vegetación y plasticidad genética de esta especie (Peterson y Shaw, 2003; Moo et al., 2013). Recientemente, Valderrama et al. (2011), registró que L. gomezi es la principal especie transmisora en Panamá y presenta una gran variabilidad genómica, con gran potencial de colonización, que le confiere la capacidad de migrar o adaptarse a cambios del medio ambiente. Además, L. gomezi presenta una amplia distribución en Venezuela, con el modelo de nicho ecológico, se muestra una distribución ideal hacia la zona noroccidental del país con varias coberturas vegetales y amplio rango de altura (Sánchez et al., 2015).
Por su parte, L. ovallesi se mostró como la especie más vulnerable al cambio climático. Aunque Sánchez et al. (2015), clasifica a la especie como propia de la región de los Andes Venezolanos, con una distribución potencial hacia la zona noroccidental y oriental de Venezuela. En un futuro inmediato esta especie, restringiría su distribución hacia el Valle del Mocotíes y para 2050 retomaría espacios de los municipios de la zona Panamericana, Campo Elías, Libertador y municipios de tradición turística, como Santo Domingo y para 2080 ocuparía nuevas zonas de los Pueblos del Sur. González et al. (2014) registraron una reducción de la distribución espacial, en las proyecciones de cambio climático de transmisores de leishmaniasis visceral, de Lutzomyia longipalpis y Lutzomyia evansi en Colombia. Esto podría deberse a diferencias genéticas presentes en las especies, a su adaptación y la capacidad de adecuación a los aumentos de temperatura.
Aunque, Feliciangeli (1987) registró que L. gomezi es afectada por la temperatura y L. ovallesi por la precipitación, lo que podría explicar, que cada entorno geográfico tiene sus propias características y que la distribución de una especie en un entorno depende de una serie de factores. A esto se le suma registros contradictorios con relación al efecto de la altitud en la distribución potencial de los flebotominos (Moo et al., 2013). A su vez, el cambio climático genera además, del incremento en la temperatura, cambios en los patrones de precipitaciones, alteraciones en el uso del suelo, cobertura vegetal y eventos bioclimáticos que pueden originar adaptaciones particulares entre las especies (Fischer et al., 2011; González et al., 2014).
Por otro lado, para la especie L. walkeri, el efecto del cambio climático producirá leves cambios en su distribución para el año 2080, que podría originar nuevos espacios de distribución en el municipio más poblado del Libertador. Si bien L. walkeri es la cuarta especie en orden de abundancia para las zonas bajas del estado Mérida, Añez et al. (1988) y Feliciangeli et al. (1988), la refieren como una especie con gran capacidad de adaptación. La presencia de dicha especie en Venezuela no está bien documentada y aún no se tiene certeza que sea un vector de Leishmania (Feliciangeli et al., 2006). Sin embargo, Oraá (2013) la reportó con infección natural en el estado Mérida.
Para la enfermedad, los modelos matemáticos de calentamiento global predicen un aumento dramático en la incidencia de leishmaniasis visceral y un ligero aumento en la incidencia de leishmaniasis cutánea (Fischer et al., 2011). Esto podría ser debido a diferencias en cómo Leishmania infantum Leishman y Donovan, 1903, reaccionaria a los aumentos de temperatura. Aunque P. perniciosus, vector de leishmaniasis visceral, disminuirá su abundancia, debido a efectos adversos de las altas temperaturas, en contraste se predice que la leishmaniasis visceral se incrementaría (Kuhn, 1999).
De los modelos bajo escenarios de cambio climático de las principales especies transmisoras de leishmaniasis cutánea en el estado Mérida, es importante resaltar el grado de solapamiento del espacio geográfico entre las principales especies vectoras en determinadas áreas, donde las condiciones serían las más favorables para su presencia, incluyendo nuevos espacios en áreas más pobladas y turísticas del estado Mérida, que implicarían un mayor riesgo de transmisión.
Es de esperar que si la temperatura ambiental, alcanza valores máximos, la transmisión podría cesar por completo, reduciendo los casos de leishmaniasis, ya que la capacidad vectorial podría aumentar significativamente debido al acortamiento del período de incubación y se daría una disminución en la supervivencia del vector (Benkova y Volf, 2007). Esto sugiere que los cambios de temperatura podrían afectar a la dinámica de desarrollo del insecto, de tal manera que se pudiera suprimir la transmisión si las condiciones ambientales se extienden más allá de la capacidad de supervivencia y adaptación (Bounoua et al., 2013). Sin embargo, los modelos de predicción a futuro bajo el efecto del cambio climático en el estado Mérida exacerban los riesgo de infección para leishmaniasis con expansión de las áreas de transmisión por la principal especie transmisora L. youngi y el solapamiento entre las principales especies en zonas más pobladas, como también es reportado para otras especies de flebotominos en otras latitudes (González et al., 2010).
Los modelos predictivos reflejan el efecto del cambio climático como una expansión en la transmisión y distribución de la leishmaniasis (Sutherst, 2001). Según Ready (2008), los modelos matemáticos no son concluyentes, sobre el efecto del cambio climático en la expansión de la leishmaniasis y se hacen necesarios más estudios, como investigar la adaptabilidad de los vectores a ese cambio climático. Un incremento en la temperatura y una disminución en la precipitación, pueden variar o crear las condiciones para la endemicidad de la leishmaniasis, si se encuentran dentro del rango óptimo para los vectores, hospedadores vertebrados y el parásito. La generación de los mapas de proyección sobre cambio climático de L. youngi, L. gomezi, L. ovallesi y L. walkeri, en el estado Mérida, permitió evidenciar cambios en la distribución futura de las principales especies de flebotominos en las zonas más pobladas del estado Mérida, lo que sugiere un mayor riesgo de transmisión de la leishmaniasis, principalmente en las áreas de solapamiento, información relevante para los entes de salud pública.
AGRADECIMIENTOS
Los autores agradecen la colaboración de todas las familias que apoyaron la realización de las capturas peridomiciliaria de los flebotominos, a la Universidad de Los Andes y al apoyo financiero del Proyecto Estratégico del FONACIT-Fondo Nacional de Ciencias, Tecnología e Innovación Nº 2011000371, bajo la coordinación de la Dra. Elsa Nieves.
BIBLIOGRAFÍA
Alexander, B. y Maroli, M. 2003. Control of phlebotomine sandflies. Medical and Veterinary Entomology 17: 1-18.
Alvar, J., Vélez, I., Bern, C., Herrero, M., Desjeux, P. y Cano, J. 2012. Leishmaniasis world wide and global estimates of its incidence. PLoS One 7(2):1-12.
Anderson, R., Lew, D. y Peterson, A. 2003. Evaluating predictive models of species’ distributions: criteria for selecting optimal models. Ecological Modelling 162:211-232.
Ataroff, M. y Sarmiento, L. 2004. Las unidades ecológicas de los Andes de Venezuela. En: La Marca, E., Soriano, P. (eds). Reptiles de Los Andes de Venezuela. Fundación Polar, Codepre-ULA, Fundacite-Mérida. Biogeos.
Bässler, C., Müller, J., Hothorn, T. y Kneib, T. 2009. Estimation of the extinction risk for high-montane species as a consequence of global warming and assessment of their suitability as cross-taxon indicators. Ecological Indicators. 10:341-352.
Benkova, I. y Volf, P. 2007. Effect of Temperature on Metabolism of Phlebotomus papatasi (Diptera: Psychodidae). Entomological Society of America 44:150–154.
Blanco, J. 2013. Modelos ecológicos: descripción, explicación y predicción. Ecosistemas 22(3):1-5.
Bounoua, L., Kahime, K., Houti, L., Blakey, T., Ebi, K., Zhang, P., Imhoff, M., Thome, K., Dudek, C., Sahabi, S., Messouli, M., Makhlouf, B., Laamrani, A. y Boumezzough, A. 2013. Linking climate to incidence of zoonotic cutaneous Leishmaniasis (L. major) in Pre-Saharan North Africa. International Journal of Environmental Research and Public Health 10:3172-91.
Cabaniel, G., Rada, L., Blanco, J., Rodríguez, A. y Escalera, J. 2005. Impacto de los eventos de El Niño Southern oscillation (ENSO) sobre la leishmaniosis cutánea en Sucre, Venezuela, a través del uso de información satelital, 1994 - 2003. Revista Peruana de Medicina Experimental y Salud Publica 22:32-38.
Campbell, D., Dujardin, J., Martínez, E., Feliciangeli, M., Pérez, J., Passerat de Silans, L. y Desjeux, P. 2001. Domestic and peridomestic transmission of American cutaneous leishmaniasis: changing epidemiological patterns present new control opportunities. Memórias do Instituto Oswaldo Cruz 96: 159-162.
Cárdenas, R., Sandoval, C., Rodríguez, A. y Franco, C. 2006. Impact of climate variability in the occurrence of leishmaniasis in northeastern Colombia. American Journal of Tropical Medicine and Hygiene 75:273-277.
Cross, E., Newcomb, W. y Tucker, C. 1996. Use of weather data and remote sensing to predict the geographic and seasonal distribution of Phlebotomus papatasi in southwest Asia. American Journal of Tropical Medicine and Hygiene 54:451–6.
Cross, E. y Hyams, K. 1996. The potential effect of global warming on the geographic and seasonal distribution of Phebotomus papatasi in southwest Asia. Environmental Health Perspectives 104:724-727.
Delgado, T. y Suarez, D. 2009. Efectos del cambio climático en la diversidad vegetal del corredor de conservación comunitaria Reserva Ecológica El Ángel- Bosque Protector Golondrinas en el norte del Ecuador. Ecología Aplicada 8(2):27-36.
Desjeux, P. 2001. The Increase in Risk Factors for the Leishmaniases Worldwide. Transactions Royal Society of Tropical Medicine and Hygiene 95(3):239-243.
Donalisio, M., Peterson, A., Costa, P., da Silva, F., Valencia, H., Shaw, J. y Filho, S. 2012. Microspatial Distributional Patterns of Vectors of Cutaneous Leishmaniasis in Pernambuco, Northeastern Brazil. Journal of Tropical Medicine 2012: 1-8.
Feliciangeli, M. 1987. Ecology of sandflies (Diptera:Psychodidae) in a restricted focus of cutaneous leishmaniasis in northern Venezuela. III. Seasonal fluctuation. Memórias do Instituto Oswaldo Cruz 82:167-176.
Fischer, D., Thomas, S. y Beierkuhnlein, C. 2011.Modelling climatic suitability and dispersal for disease vectors: the example of a phlebotomine sandfly in Europe. Procedia Environmental Sciencies 7:164-169.
Gaertner, M., Gutiérrez, J. y Castro, M. 2012. Escenarios regionales de cambio climático. Revista Española de Física 26(2):1-8.
González, C., Wang, O., Strutz, S., González, C., Sánchez, V. y Sarkar, S. 2010. Climate Change and Risk of Leishmaniasis in North America: Predictions from Ecological Niche Models of Vector and Reservoir Species. PLoS Neglected Tropical Diseases 4:1-15.
González, C., Paz, A. y Ferro, C. 2014. Predicted altitudinal shifts and reduced spatial distribution of Leishmania infantum vector species under climate change scenarios. Colombia. Acta Tropica 129(2014): 83-90.
Gordon, C., Cooper, C., Senior, C., Banks, H., Gregory, J., Johns, T., Mitchell, J. y Wood, R. 2000. The simulation of SST, sea ice extents and ocean heat transports in a version of the Hadley Centre coupled model without flux adjustments. Climate Dynamics 16: 147-168.
Graham, C., Moritz, C. y Williams, S. 2006 Habitat history improves prediction of biodiversity in rainforest fauna. Proceedings of the National Academy of Sciences 103: 632-636.
Hartemink, N., Vanwambeke, S., Heesterbeek, H., Rogers, D., Morley, D., Pesson, B., Davies, C., Mahamdallie, S. y Ready, P. 2011. Integrated mapping of establishment risk for merging vector-borne infections: a case study of canine leishmaniasis in southwest France. PLoS One 6(8):1-12.
Hijmans, R., Cameron, S., Parra, J., Jones, P. y Jarvis, A. 2005a.Very high resolution interpolated climate surfaces for global land areas. International Journal of Climatology 25:1965–1978.
Hijmans, R., Guarino, L., Jarvis, A., O’Brien, R. y Mathur, P. 2005b. DIVA-GIS, versión 7.5. URL: http://www.diva-gis. org/. Consultado: 25 julio 2014.
Honty, G. 2011. Cambio climático: Negociaciones y consecuencias para América Latina. CLAES - Centro Latino Americano de Ecología Social, Uruguay.
Kigadye, E., Nkwengulila, G., Magesa, S., Abdulla, S. 2010. Diversity, spatial and temporal abundance of Anopheles gambiae complex in the Rufiji River basin, south-eastern Tanzania. Tanzania Journal of Health Research 12:68-72.
Kilpatrick, A., Fonseca, D., Ebel, G., Reddy, M. y Kramer, L. 2010. Spatial and temporal variation in vector competence of Culex pipiens and Cx. restuans mosquitoes for West Nile virus. American Journal of Tropical Medicine and Hygiene 77:667–671.
Kuhn, K. 1999. Global warming and leishmaniasis in Italy. Bull. Tropical Medicine International Health 7:1–2.
Loiola, C., da Silva, D. y Galati, E. 2007. Phlebotomine fauna (Diptera: Psychodidae) and species abundance in an endemic area of American cutaneous leishmaniasis in southeastern Minas Gerais, Brazil. Memórias do Instituto Oswaldo Cruz 102(5):581-585.
López, R. y Molina, R. 2005. Cambio climático en España y riesgo de enfermedades infecciosas y parasitarias transmitidas por artrópodos y roedores. Revista Española de Salud Pública 79(2): 177-190.
Lugo, Y., Premoli, G. y Moreno, E. 1999. Detection of localized cutaneous leishmaniasis using conventional assay and Polymerase Chain Reaction: a report on three Venezuelan family groups. Boletín Dirección Malariología Saneamiento Ambiental 39:20-26.
Lugo, Y., Valera, M., Alarcón, M., Moreno, E., Premoli, G. y Colasante, C. 2003. Detección de Leishmania (Viannia) braziliensis en el endotelio vascular de lesiones de pacientes con leishmaniasis cutánea localizada. Investigación Clínica 44:61-76.
Magnuson, J. 2001. 150-year global ice record reveals major warming trend. International American Institute Global Change Research 24:22–25.
Maingon, R., Feliciangeli, D., Guzmán, B., Rodríguez, N., Convit, J., Adamson, R., Chance, M., Petralanda, I., Dougherty, M. y Ward, R. 1994. Cutaneous leishmaniasis in Táchira state, Venezuela. Annals Tropical Medical Parasitology 88:29-36.
Moo, D., Ibarra, C., Rebollar, E., Ibáñez, S., González, C. y Ramsey, J. 2013. Current and future niche of North and Central American sand flies (Diptera: Psychodidae) in climate change scenarios. PLoS Neglected Tropical Diseases 7(9): 1-13.
Moreno, E. y Scorza, J. 1998. Productos de excreción de Leishmania spp. de la región Andino – Venezolana. Revista de Ecología Latinoamericana Ambiental 5: 53-60.
Neuber, H. 2008. Leishmaniasis. Journal der Deutschen Dermatologischen Gesellschaft Impact Factor y Information 6: 754-765.
Nieves, E., Oraá, L., Rondón, Y., Sánchez, M., Sánchez, Y., Rujano, M., Rondón, M., Rojas, M., González, N. y Cazorla, D. 2014a. Riesgo de transmisión de Leishmania (Kinetoplastida: Trypanosomatidae) en Mérida Venezuela. Avances en Biomedicina 3: 57-64.
Nieves, E., Oraá, L., Rondón, Y., Sánchez, M., Sánchez, Y., Rojas, M., Rondón, M., Rujano, M., González, N. y Cazorla, D. 2014b. Effect of Environmental Disturbance on the Population of Sandflies and Leishmania Transmission in an Endemic Area of Venezuela. Journal of Tropical Medicine 2014:1-7.
Nieves, E., Oraá, L., Rondón, Y., Sánchez, M., Sánchez, Y., Rujano, M., Rondón, M., Rojas, M., Gonzalez, N. y Cazorla, D. 2015. Distribution of Vector Sandflies Leishmaniasis from an Endemic Area of Venezuela. Journal Tropical Diseases 3:1-7.
OMS. 2010. Control de la Leishmaniasis. Serie de Informes Técnicos 949. Ginebra, Suiza.
Oraá, L. 2013. Distribución, diversidad e influencia de variables ambientales y antropogénicas en las principales especies de flebotominos en Mérida – Venezuela. Tesis de Grado. Universidad de Los Andes. Mérida, Venezuela.
Pabón, J. y Nicholls, R. 2005. El cambio climático y la salud humana. Biomédica 25(1):1-4.
Parra, G. 2010. Sistemas de información geográfica y sensores remotos. Aplicaciones en enfermedades transmitidas por vectores. CES Medicina 24(2): 75-89.
Peterson, A. y Robins, C. 2003. Using ecological-niche modeling to predict barred owl invasions with implications for spotted owl conservation. Conservation Biology 17:11611165.
Peterson, A. y Shaw, J. 2003. Lutzomyia vectors for cutaneous leishmaniasis in Southern Brazil: ecological niche models, predicted geographic distributions, and climate change effects. International Journal Parasitology 33:919-931.
Peterson, A. 2006. Ecologic niche modeling and spatial patterns of disease transmission. Emerging Infectious Diseases 12:1822-1826.
Phillips, J., Anderson, P. y Schapire, E. 2006. Maximum entropy modeling of species geographic distributions. Ecological Modeling 190:231-259.
Phillips, J. y Dudik, M. 2008. Modeling of species distributions with MaxEnt: new extensions and a comprehensive evaluation. Ecography 31:161-175.
Pope, V., Gallani, M., Rowntree, P. y Stratton, R. 2000. The impact of new physical parametrizations in the Hadley Centre climate model: HadAM3. Climate Dynamics 16: 123–146.
Ready, P. 2008. Leishmaniasis emergence and climate change. Revue scientifique et technique 27(2):399-412.
Reiter, P. 2001. Climate change and mosquito borne disease. Environmental Health Perspectives 109(1): 141–161.
Rodríguez, N., Carrero, R., De Lima, H., Sandoval, I., Fernández, A. y Barrios, M. 2007. Impacto de Fenómenos Naturales (Deslaves y vaguadas) sobre la epidemiologia de la Leishmaniasis cutánea en zonas del estado Mérida. Salus 11:43-47.
Rodríguez, A., González, Y., Benítez, J., López, M., Harter, R., Vilca, L. y Cárdenas, R. 2010. Asociación entre la incidencia de leishmaniosis cutánea y el índice de desarrollo humano y sus componentes en cuatro estados endémicos de Venezuela. Revista Peruana de Medicina Experimental y Salud Pública 27:22-30.
Rondón, Y. 2015. Detección Parasitológica y Molecular de Leishmania en el Intestino de Flebotominos Vectores. Tesis de Grado. Universidad de Los Andes. Mérida Venezuela. 82p
Salomón, O., Rosa, J., Stein, M., Quintana, M., Fernández, M., Visintin, A., Spinelli, G., Bogado de Pascual, M., Molinari, M., Morán, M., Valdez, D. y Romero, M. 2008. Phlebotominae (Diptera: Psycodidae) fauna in the Chaco región and Cutaneous Leishmaniasis transmission patterns in Argentina. Memórias do Instituto Oswaldo Cruz 103(6): 578-584.
Sánchez, I., Liria, J. y Feliciangeli, M. 2015. Ecological Niche Modeling of Seventeen Sandflies Species (Diptera, Psychodidae, Phlebotominae) from Venezuela. International Journal of Zoology 2015:1-9.
Scheldeman, X., y Van Zonneveld, M. 2011. Manual de capacitación en análisis espacial de diversidad y distribución de plantas. Bioversity International.
Scorza, J., Valera, M., Moreno, E. y Jaimes, R. 1983. Epidemiologic survey of cutaneous leishmaniasis: an experience in Merida, Venezuela. Bulletin Panamerican Health Organ 7:361- 373.
Scorza, J., Castillo, L., Rezzano, S., Márquez, M. y Márquez, J. 1985. El papel del cafeto en la endemicidad de la leishmaniasis cutánea en Venezuela. Boletín Malariología Saneamiento Ambiental 25:82-88.
Shaw, J. 2007. The leishmaniases: survival and expansion in a changing world. A mini-review. Memórias do Instituto Oswaldo Cruz 102: 541-547.
Stott, P., Tett, S., Jones, G., Allen, M., Ingram, W. y Mitchell, J. 2001. Attribution of Twentieth Century Temperature Change to Natural and Anthropogenic Causes. Climate Dynamics 17:1-22.
Sutherst, R. 2001. Global change and human vulnerability to Vector-Born diseases. Clinical Microbiology Reviews 5:136-73.
Thomson, M., Elnaiem, D., Ashford, R. y Connor, S. 1999. Towards a kalaazar risk map for Sudan: mapping the potential distribution of Phlebotomus orientalis using digital data of environmental variables. Tropical Medicine International Health 4:105-113.
Valderrama, A., Tavares, M. y Andrade, J. 2011. Anthropogenic influence on the distribution, abundance and diversity of sandfly species (Diptera: Phlebotominae: Psychodidae), vectors of cutaneous Leishmaniasis in Panama. Memórias do Instituto Oswaldo Cruz 106(8):1024-1031.
Valera, M., Moreno, E. y Scorza, J. 1978. Cincuenta y seis casos de leishmaniasis tegumentaria en la cuenca de los ríos Chama - Mocotíes (Estado Mérida, Venezuela). Boletín Dirección Malariología Saneamiento Ambiental 28:238-247.
Varela, S., Mateo, R., García, R. y Fernández, F. 2014. Macroecología y ecoinformática: sesgos, errores y predicciones en el modelado de distribuciones. Ecosistemas 23(1):46-53.
Vásquez, A., González, A., Góngora A., Prieto, E., Suárez, E. y Buitrago, L. 2013. Seasonal variation and natural infection of Lutzomyia antunesi (Diptera: Psychodidae: Phlebotominae), an endemic species in the Orinoquia region of Colombia. Memorias Instituto Oswaldo Cruz 108(4): 463-469.
Wang, X., Huang, X., Jiang, L. y Qiao, G. 2010. Predicting potential distribution of chestnut phylloxerid (Hemiptera: Phylloxeridae) based on GARP and Maxent ecological niche models. Journal of Applied Entomology 134: 45-54.
Wisz, M., Hijmans, R., Li, J., Peterson, A., Graham, C. y Guisan, A. 2008. Predicting Species Distributions Working Group. Effects of sample size on the performance of species distribution models. Diversity and Distributions 14:763-773.
Young, D. y Duncan, M. 1994. Guide to the identification and geographic distribution of Lutzomyia sandflies in México, the West Indies, Central and South America (Diptera: Psychodidae). Memories of the American Entomological 54:779-881.
Fecha de recepción: 03/09/2015
Fecha de aceptación: 23/11/2015
Para citar este artículo: Nieves, E., M. Rujano, H. Ospino, L. Oraá, Y. Rondón, M. Sánchez, M. Rondón, Y. Sánchez, M. Rojas, N. González y D. Cazorla. 2015. Efectos del cambio climático sobre la distribución potencial de los Flebotominos transmisores de leishmaniasis en Mérida Venezuela. Intropica Vol. 10: 60 - 73