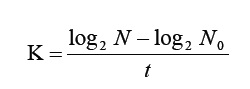
EFECTO DEL FOTOPERIODO SOBRE EL CRECIMIENTO DE LA DIATOMEA
Chaetoceros calcitrans (CLON C-CAL) EN CULTIVOS ESTÁTICOS
Alina Villa, Diana Herazo y Ana Carolina Torregroza
Dirección de los autores:
Centro de Investigación de Acuicultura de Colombia (CENIACUA). E-mail: alina.villam@gmail.com (A.V.) .Universidad de Córdoba, Facultad de
Medicina Veterinaria y Zootecnia, Carrera 6 N° 76-103, Montería, Colombia. E-mail: dherazo@correo.unicordoba.edu.co (D.H). Universidad de la
Costa, Facultad de ciencias ambientales, calle 58 N° 55-66, Barranquilla, Colombia. E-mail: atorregr4@cuc.edu.co (A.C.T)
Fecha de recepción: 07/06/2014
Fecha de aceptación: 13/11/2014
Para citar este artículo: Villa, A., D. Herazo y A. C. Torregroza. 2014. Efecto del fotoperiodo sobre el crecimiento de la diatomea Chaetoceros calcitrans (Clon C-Cal) en cultivos estáticos. Revista Intropica 9: 111 - 117
RESUMEN
Se evaluó el crecimiento de Chaetoceros calcitrans en un sistema estático a 35 ppt de salinidad y con los fotoperiodos de 0:24, 6:18, 10:14 y 24:0 horas luz:oscuridad. Los bioensayos se realizaron en frascos de 200 ml por cuadriplicado bajo condiciones controladas de laboratorio, utilizando el medio de cultivo F/2. Las variables monitoreadas cada 48 horas fueron luz, temperatura, pH y conteos celulares directos. El fotoperiodo afectó de manera directa la concentración celular y la tasa de crecimiento de C. calcitrans, siendo mayores con 24 horas luz, con valores de 2´713,333 cel.ml-1 y 0,17 div.dia-1, mientras que la concentración mínima y la tasa de crecimiento con 0 horas luz fue 0 cel.ml-1 y -0,03 div.dia-1 , respectivamente. Se observó una relación lineal positiva (r=0.567; F(1,10)=4.754; P<0.05) entre el fotoperiodo y la tasa de crecimiento algal. El pH osciló entre 6,7 y 7,5 con valores que tendieron a disminuir en todos los tratamientos a medida que avanzaron los días de cultivo. Se presentó una correlación negativa, poco significativa entre el pH y la densidad celular de C. calcitrans (r2=-0,369). Los resultados indican que el crecimiento de C. calcitrans es determinado por el fotoperiodo con un crecimiento óptimo a luz continua.
PALABRAS CLAVE: Chaetoceros calcitrans, densidad celular, fotoperiodo
EFFECT OF PHOTOPERIOD ON THE GROWTH OF DIATOM Chaetoceros calcitrans
(C-CAL) IN STATIC CULTURES
ABSTRACT
Growth of Chaetoceros calcitrans was evaluated in a static system at 35 ppt salinity and different photoperiods 0:24, 6:18, 10:14 y 24:0 hours light:dark. Bioassays were performed in bottles of 200 ml in quadruplicate under controlled laboratory conditions, using the medium F/2. Light, temperature, pH and direct cell counts, were monitored every 48 hours. The photoperiod directly affected cell concentration and growth rate of C. calcitrans, being higher with 24 h/light, with values of 2'713,333 cel.ml-1 and 0.17 div.day-1, while the low cell concentration and growth rate were 0 cel.ml-1 and -0.03 div.dia-1, respectively with 0 h/light. A positive linear relationship (r=0.567; F(1,10)=4.754; P>0.05) was observed between photoperiod and algal growth rate. The pH ranged between 6.7 and 7.5 with values tended to decrease in all treatments with the time. A negative correlation between pH and cell density of C. calcitrans (r2=-0.369) was detected. The results indicate that the growth of C. calcitrans is determined by photoperiod with optimal growth at continuous light.
KEYWORDS: Chaetoceros calcitrans, cell density, photoperiod
INTRODUCCIÓN
Las microalgas marinas constituyen la base de la cadena nutritiva en el cultivo de moluscos, peces y crustáceos. Además, sirven de alimento a especies intermediarias utilizadas como presas vivas en acuicultura (Brown et al., 1997). Las microalgas requieren diferentes factores para su crecimiento, dentro de estos se encuentran los parámetros físico-químicos tales como luz, temperatura, salinidad, pH, CO2 y fotoperiodo (Tzovenis et al., 2003) y nutritivos como macro nutrientes, que son utilizados para sintetizar compuestos orgánicos y los micronutrientes usados como catalizadores (Becker, 2004). El crecimiento microalgal se rige por la ley del mínimo, es decir, el factor limitante del crecimiento es aquel que está presente en cantidades más próximas al mínimo crítico necesario, sin embargo, las respuestas de las microalgas frente a cualquier factor limitante puede ser diversa. En el caso del pH, esta respuesta varía ampliamente, debido a que este determina la solubilidad del dióxido de carbono y de los minerales en los cultivos e influye directa o indirectamente en su metabolismo (Murray et al., 2003).
El fotoperiodo (tiempo de exposición a la luz y oscuridad) tiene efecto sobre los ciclos de vida y actividades metabólicas de las microalgas tanto en cultivo como en la naturaleza (Humprey, 1979). En condiciones naturales, la mayoría de las algas se establecen en periodos alternos de luz:oscuridad, sin embargo, en la mayoría de los laboratorios de microalgas se mantiene constante la iluminación en los cultivos al interior, debido a que se favorece la división celular en ciertas microalgas como las diatomeas; cuando se llega a utilizar los ciclos luz:oscuridad, es con el fin de simular las condiciones naturales o la de sincronizar los cultivos (Humprey, 1979). Comercialmente, los géneros más destacados han sido Isochrysis, Nannochloropsis, Chlorella, Tetraselmis, Dunaliella, Rhodomonas, Pavlova, Chaetoceros, Nitzschia y Thalassiosira (Wikfors y Ohno, 2001).
La microalga Chaetoceros calcitrans hace parte de la división Bacillariophyta, siendo una de sus características principales presentar plastos marrones o amarillos (fucoxantina o beta-caroteno) y estar envueltas en cubiertas de sílice. En cuanto a su composición bioquímica presentan un alto contenido de ácidos grasos poliinsaturados (EPA y AA, no tiene DHA), alta vitamina C y E, una tasa de crecimiento de 1.8 div.dia-1, y un número de generaciones para que la población se duplique igual a 4 (Sánchez-Saavedra y Voltolina, 1994). Es por lo anterior que, la microalga C. calcitrans ha sido utilizada en acuicultura marina como alimento vivo dado su valor nutritivo, principalmente para moluscos y crustáceos, además, en cultivos tiene la capacidad de generar buenas densidades celulares (Wikfors y Ohno, 2001), lo que la hace una especie ideal para investigación principalmente en las relacionadas con la potencialización de su producción. En este sentido, el objetivo del presente estudio fue evaluar el efecto del fotoperiodo en el crecimiento de Chateoceros calcitrans (C-CAL) en cultivos estáticos.
MATERIALES Y MÉTODOS
La cepa de la microalga C. calcitrans (CLON C-CAL) fue obtenida del stock de microalgas del Laboratorio de Microalgas de la Universidad Católica del Norte (Coquimbo, Chile). Esta cepa ha sido conservada en el cepario del Laboratorio de Moluscos y Microalgas de la Universidad del Magdalena (Santa Marta, Colombia) en medio F/2 (Guillard, 1975) a una temperatura de 21 ± 1 °C, intensidad lumínica de 1200 lux, aireación constante y salinidad de 35 ± 1 ppt.
El experimento estuvo constituido por cuatro tratamientos cada uno con tres réplicas dependiendo las horas de exposición a la luz de la microalga. Los tratamientos fueron 24, 10, 6 y 0 horas luz, las cuales estuvieron definidas por el cubrimiento de los recipientes con papel aluminio, evitando la penetración de luz durante las horas de oscuridad. Cada réplica consistió en un frasco de vidrio (beakers con capacidad de 200 ml) con 100 ml de medio F/2. El medio fue preparado con agua de mar captada de la bahía de Taganga (11° 16' N, 74° 11' O), Caribe colombiano, microfiltrada (1 μm) y esterilizada (120 °C/15 min). En cada frasco fue sembrado 10 ml de un mismo inóculo en fase exponencial, cuya concentración fue previamente determinada. Estos fueron colocados en una estantería, sin suministro de aireación y provistos de iluminación constante mediante lámparas fluorescentes (75 W) a una intensidad lumínica, temperatura y salinidad constantes, determinados diariamente en una de las réplicas. El pH también fue medido diariamente en cada frasco. Los frascos fueron agitados una vez al día, reponiendo el volumen perdido por evaporación y toma de muestras, con agua destilada.
Cada 48 horas se determinó la densidad celular (D) de cada réplica a partir de una alícuota de 1 ml extraída previa homogenización del cultivo. Estas muestras fueron fijadas con solución Transeau. Los conteos fueron realizados mediante observación por el microscopio utilizando una cámara Neubauer. El cálculo de la densidad celular (D) se realizó utilizando la siguiente ecuación:
D (células ml-1) = C x 10000 ml-1
Dónde: C = número de células promedio contadas en cada cuadrante de 1 mm.
Finalmente, se calculó la tasa de crecimiento celular (K) para cada tratamiento durante la fase exponencial, de acuerdo con la ecuación descrita por Fogg (1965):
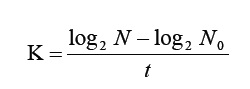
Donde K es la tasa de crecimiento celular, log2 es el logaritmo en base 2, N la densidad celular final, N0 la densidad celular inicial y t el tiempo de cultivo en días. Para cada tratamiento se tomó como referencia el número de días en que se observó una disminución significativa de la densidad celular.
Con el fin de evaluar el efecto fotoperiodo sobre el crecimiento a lo largo del tiempo de cultivo se realizó una ANOVA a una vía de medidas repetidas con previa comprobación de los supuestos de homogeneidad, normalidad y esfericidad. Al observar diferencias entre los tratamientos se llevó a cabo una prueba post-hoc (Tukey-HSD). También se realizó un análisis de correlación entre los valores de pH y la densidad celular de C.calcitrans para determinar la existencia de asociaciones entre estas variables. Finalmente, se llevó a cabo un análisis de regresión lineal entre la tasa de crecimiento de C. calcitrans y el fotoperiodo, a fin de establecer la relación entre ellas. Los análisis estadísticos se efectuaron mediante el programa estadístico SPSS 20,0. Para las decisiones se usó un nivel de significancia del 5 %.
RESULTADOS
Las densidades iniciales promedio de los cultivos de 24, 10, 6 y 0 horas luz de C. calcitrans fueron 243,333 cel.ml-1, 221,667 cel.ml-1, 255,000 cel.ml-1 y 146,667 cel.ml-1 respectivamente, las que después de 13 días de cultivo para los tratamientos de 24, 10 y 6 horas luz aumentaron llegando a 1,080,000 cel.ml-1, 933,333 cel. ml-1, 1,023,333 cel.ml-1 respectivamente, mientras que a los 9 días de cultivo para el tratamiento de 0 horas luz el número de células descendió a 0 cel.ml-1 (Figura 1). El análisis de varianza arrojó diferencias significativas entre los tratamientos (Tabla 1), observándose mediante la prueba de Tukey-HSD tres grupos homogéneos: el tratamiento de 0 horas, los tratamientos de 6 y 10 horas luz, y el tratamiento de 10 con el de 24 horas (Tabla 2). Durante los diferentes periodos de luz se observó que el tratamiento sometido a 24 horas luz, tuvo una fase exponencial de rápido crecimiento celular a medida que transcurrió el experimento, alcanzando 2,713,333 cel.ml-1 a los 9 días de cultivo; algo similar ocurrió en el tratamiento con el fotoperiodo 10 horas luz, el cual alcanzó su fase exponencial el día 7, con una densidad celular promedio de 2,161,667 cel.ml-1. El tratamiento de 6 horas luz, obtuvo su pico más alto de crecimiento el día 11, presentando una densidad celular de 1.116.667 cel.ml-1.
La tasa de división celular K presentó el máximo valor a exposición continua de luz y siendo el valor más bajo el correspondiente a 0 horas luz (Tabla 3). La regresión lineal entre el fotoperiodo y la tasa de crecimiento celular mostró una relación lineal positiva (r=0,567; F(1,10)=4,754; P<0,05). Es decir, el crecimiento de C. calcitrans estuvo determinado por el fotoperiodo.
La temperatura del cultivo osciló entre 17 y 20 °C y la intensidad lumínica varió entre 2500 y 3900 Lux/FC. El pH de los tratamientos al inicio del estudio fue de 7,39 ± 0,040 y al terminar fue de 6,83 ± 0,100, es decir, por lo general neutro, aunque se observó una tendencia a disminuir al pasar el tiempo de cultivo (Figura 2). Al realizar el análisis de correlación entre pH y la densidad celular se encontró una correlación inversa entre las variables (a medida que disminuye el pH, aumenta la densidad celular) y la correlación es débil tomando como referencia el coeficiente de Pearson (r=-0,369, P>0,05).
DISCUSIÓN
El análisis de la influencia del fotoperiodo arrojó que la velocidad de crecimiento de las microalgas se reduce sustancialmente en ciclos de 10:14, 6:18, 0:24 horas luz:oscuridad, con producciones de biomasa significativamente menores respecto al de iluminación continua (24:0 horas luz:oscuridad). Prácticamente la totalidad de la biomasa producida se genera durante las horas de irradiación, mientras que durante los periodos de oscuridad el crecimiento es mínimo e incluso existe decrecimiento (o pérdida por consumo durante la respiración celular) de la biomasa celular que es producida durante el período de luz (Ferrero, 2011).
Mediante la tasa de crecimiento se observó la diferenciación de las tres fases típicas del crecimiento microalgal. Una fase de ajuste o inicial que duró alrededor de tres días, seguida por una fase exponencial que se prolongó entre siete y once días dependiendo del fotoperiodo al que fue expuesto cada tratamiento y a partir del día trece una fase de retardo (Figura 1). A medida que se acortó el número de horas de exposición a la luz se redujo la densidad celular, lo cual fue muy notorio en el tratamiento de 0 horas luz, el cual presentó el menor incremento en densidad celular con 258,333 cel.ml-1 al tercer día de cultivo. Según una serie de investigadores (Álvarez 1994; Uribe 1994; Alveal et al., 1995) la curva de crecimiento celular está compuesta por cinco fases, las que se definen por el número de células presentes en un tiempo determinado y por las condiciones generales del cultivo: a) Fase de ajuste (las microalgas se adaptan a las nuevas condiciones de cultivo); b) Fase exponencial (la división celular se incrementa en función del tiempo, debido a la asimilación de nutrientes desde el medio y a su activo proceso de reproducción); c) Fase de retardo (la tasa de crecimiento se reduce, por lo que el tiempo para duplicar la población aumenta); d) Fase estacionaria (el factor limitante y la tasa de crecimiento están equilibrados, las densidades celulares se mantienen relativamente constantes) y e) Fase de declinación (la tasa de crecimiento es superada por la tasa de mortalidad de la población). El crecimiento de una población microalgal depende de la interacción de factores ambientales (temperatura, radiación fotosintéticamente activa (PAR), pH y nutrición mineral entre otros); los cuales inciden en la composición bioquímica (Mora et al., 2005).
El aumento de la densidad celular de C. calcitrans cultivado bajo condiciones de mayor tiempo de exposición lumínica coincide con los resultados obtenidos para otras microalgas como Chroomonas sp. (Bermúdez et al., 2002), Actinocyclus normanii, Neodelphineis pelágica y Cyclotella glomerata (Prieto et al., 2005) y Thalassiosira pseudonana (Lopez et al., 2009). Una condición para que haya crecimiento en la densidad microalgal es que la energía total y el carbón fijado gracias al proceso de fotosíntesis deben exceder los valores usados en la respiración (mantenimiento del metabolismo) (Velasco et al., 2009a). El tiempo de exposición a la luz juega un papel importante puesto que afecta el crecimiento y producción de biomasa de los cultivos (Tzovenis et al., 2003). En este trabajo, las diferentes condiciones de iluminación mostraron un efecto sobre la concentración celular máxima al presentar los cultivos con iluminación continua 24 horas luz un mayor crecimiento, concordando con Humprey (1979), quien encontró un crecimiento más lento en Chaetoceros didymum, Chroomonas sp., Cylindrotheca closterium, Dunaliella tertiolecta, Pavlova lutheri y Phaeodactylum tricornutum en un ciclo 12 horas luz:oscuridad en cultivos expuestos a iluminación continua.
Los valores de las densidades celulares de C. calcitrans (cel.ml-1) obtenidas en el presente estudio fueron concordantes con las reportadas por Viramontes- Robles (1991) para Tetraselmis suecica, quien evalúo el efecto de tres fotoperiodos: 12:12, 14:10 y 16:8 e iluminación continua en el crecimiento de C. muelleri, Skeletonema costatum y Tetraselmis suecica, donde las dos diatomeas crecieron bien en cualquiera de los tratamientos empleados, mientras que Tetraselmis creció menos con fotoperiodo que con iluminación continua. Los resultados de esta investigación sugieren que la densidad celular de C. calcitrans depende en forma directa del tiempo de exposición lumínica. En la mayoría de las microalgas el crecimiento se lleva a cabo durante el periodo de luz debido a que a través de la fotosíntesis se genera material orgánico y energía suficiente para este proceso, por lo que la división celular generalmente se da en el periodo de oscuridad, sin embargo en las diatomeas la división celular también se realiza en luz continua (López et al., 2009).
En todos los tratamiento el pH se caracterizó por disminuir a medida que aumentaban los días de cultivo y la densidad celular, esta relación difiere a lo reportado por Velasco et al. (2009b) quien utilizó las mismas condiciones del presente estudio en un cultivo de I. galbana, encontrando una relación directamente proporcional entre la densidad celular de los cultivos y el pH. En este estudio la relación entre la densidad celular y el pH fue inversamente proporcional en todos los tratamientos siendo más notorio en aquellos donde la exposición a la luz fue menor, esto se debe a que en las horas de oscuridad el proceso de respiración de las microalgas se vio favorecido, aumentando las concentración de CO2 y con ello la disminución del pH, manteniendo una tendencia hacia la acidez debido a que en estos tratamientos el proceso fotosintético estuvo limitado (Díaz y Ordoñez, 2006). En el tratamiento donde la exposición a la luz fue total y la densidad celular aumentó, la variación del pH con tendencias hacia la acidez puede explicarse con el hecho de que pudo existir un sombreamiento causado por la mayor densidad algal y la poca agitación del cultivo, lo que pudo impedir una fotosíntesis eficiente y con ello la producción de oxigeno que garantizara las condiciones de basicidad del cultivo (Cáceres, 2009). La variación de pH incide de manera positiva o negativa sobre el crecimiento de C. calcitrans, teniendo en cuenta que este parámetro al ser muy ácido o muy básico hace que la microalga se estrese y no lleve a cabo correctamente sus procesos metabólicos afectando directamente su desarrollo y crecimiento incluso hasta producir la muerte (Borowitzka, 1999).
Finalmente, se puede concluir que el crecimiento de C. calcitrans es determinado por el fotoperiodo con un crecimiento óptimo a luz continua, mientras que en ausencia de luz disminuye drásticamente su crecimiento. A lo largo de 9 días de cultivo la ausencia de luz en uno de los tratamientos (0 horas luz) y durante 13 días la reducción en la exposición a la radiación incidente en los otros tratamientos (6, 10 horas luz) provocó una disminución en la biomasa producida. Se presentó una relación negativa entre el aumento de la densidad celular y el pH en los diferentes fotoperiodos. Si la concentración de dióxido de carbono crece, la de iones de hidrógeno aumenta y el pH disminuye y al contrario, si disminuye la concentración de dióxido de carbono, la de iones de hidrógeno cae y el pH aumenta (Boyd y Gautier 2000). Es por lo anterior, que para cultivos de Chaetoceros calcitrans principalmente como alimento vivo en acuicultura se recomienda utilizar periodos de luz continua (24 horas luz).
AGRADECIMIENTOS
Los autores agradecen a la Dra. Luz Adriana Velasco por su apoyo y asesoría durante la realización de la investigación y al Grupo de Moluscos Marinos de la Universidad del Magdalena.
BIBLIOGRAFÍA
Alvarez, H. 1994. Introducción al Método Ficológico. Capitulo III. Escuela Superior Politécnica del Litoral, Ecuador 375 p.
Alveal, M., E. Ferrario., E. Oliveira y E. Sar. 1995. Manual de Métodos Ficológicos. Universidad de Concepción, Concepción, Chile 863 p.
Becker, W. 2004. Microalgae for Aquaculture: The Nutritional value of Microalgae for Aquaculture pp. 380- 391. En: Richmond A (Ed). Handbook of Microalgal culture: Biotechnology and Applied Phycology. Blackwell, Oxford, London. 588 p.
Bermudez, J. L., C. Ladeiros y E. Morales. 2002. Producción de biomasa de la microalga marina Chroomonas sp., en función del pH, intensidad luminosa y salinidad. Boletin de Investigaciones Marinas y Costeras 31:167-185.
Borowitzka, W. 1999. Economic evaluation of microalgal processes and products. pp. 387-409. En: Cohen Z. (ed.), Chemicals from microalgae. Taylor & Francis: London. 419 p.
Boyd, C. E. y D. Gautier. 2000. Effluent composition and water quality standards. Global Aquaculture Advocate 3 (5): 61 - 66.
Brown, M., S. Jeffrey, J. Volkman y G. Dunstan. 1997. Nutritional properties of microalgae for mariculture. Aquaculture 151: 315-331.
Cáceres, S. O. 2009. Aislamiento y Caracterización de las Principales Microalgas presentes en el sistema hidropónico del tipo raíz flotante. Universidad de Chile, Santiago, Chile 60 p
Díaz, V. y C. Ordoñez. 2006. Evaluación del pH y la agitación del medio más adecuada para el crecimiento de Dunaliella salina en condiciones de laboratorio. Tesis de pregrado. Pontificia Universidad Javeriana, Bogotá, Colombia. 84 p.
Ferrero, I. 2011. Producción de biodiesel a partir de microalgas como alternativa a los cultivos clásicos. Monografía Universidad Nacional del Litoral. Santa Fé. Argentina. http://institutoideal.org/ecologicas/wpcontent/uploads/2012/08/03-Ignacio-Ferrero.pdf
Fogg, G. E. 1965. Algal cultures and phytoplankton ecology. The University of Wisconsin Press. Madison. 175 p.
Guillard, R. L. 1975. Culture of phytoplankton for feeding marine invertebrates. pp 29-59. En: Smith, W. L y M. H. Chanley (Eds). Culture of marine invertebrate animal. Plenum Press. New York. 329 p.
Humprey, G. F. 1979. Photosynthetic characteristics of algae grown under constant illumination and light-dark regimes. Journal of Experimental Marine Biology and Ecology. 40: 63-70.
López, J. A., N. García, L. Jiménez y N. Huerta. 2009. Crecimiento de la diatomea Thalassiosira pseudonana en cultivos estáticos con iluminación continua y fotoperiodo a diferentes salinidades. Biotecnia. 52:113-22.
Mora, R., R. Moronta., J. Ortega y E. Morales. 2005. Crecimiento y producción de pigmentos de la microalga nativa Chlorella sp aislada de la represa de Tulé, Municipio de Mara, Estado de Zulía, Venezuela. Ciencia. 12 (2): 1-9.
Murray, L., A. Raab y J. Feldmann. 2003. Biotransformation of arsenate to arsenosugars by Chlorella vulgaris. Applied Organometallic Chemistry, 17: 669-674.
Prieto, M., M. Mogollón, A. Castro y L. Sierra. 2005. Efecto del medio y condiciones de cultivo en la producción de tres diatomeas marinas con potencial acuícola. Revista MVZ Córdoba, 10: 544-554.
Sánchez-Saavedra, M. P. y D. Voltolina. 1994. The chemical composition of Chaetoceros sp. (Bacillariophyceae) under different light conditions. Comparative Biochemistry and Physiological Part B: Biochemistry and Molecular Biology. 107: 39-44.
Tzovenis, I., De Pauw N y P. Sorgeloos. 2003. Optimization of T-ISO biomass production rich in essential fatty acids I. Effect of different light regimes on growth and biomass production. Aquaculture 216: 203-222.
Uribe, E. 1994. "Cultivo de peces marinos" - Cultivo de Microalgas, material docente. Departamento de Acuicultura. Facultad de Ciencias del Mar. Universidad Católica del Norte. Coquimbo. Chile: 50- 73.
Velasco. L. A., S. Carrera y J. Barros. 2009a. Producción de microalgas como alimento para pectínidos. Cap 2. Biología y cultivo de Pectínidos de interés comercial de Colombia. ed: Fondo Editorial Universidad Del Magdalena. 258 p.
Velasco, L., J. Barros-Gómez., G. Ospina-Salazar y C. Trujillo. 2009b. Efecto de la intensidad lumínica, temperatura y salinidad sobre el crecimiento de la microalga Isochrysis galbana (clon t-iso). Revista Intropica 4: 93-99.
Viramontes-Robles, F. 1991. Estudio del efecto de diferentes ciclos luz-oscuridad sobre el crecimiento y contenido de lípidos en tres especies de microalgas marinas. Tesis de licenciatura. Departamento de Ciencias Químico Biológicas. Universidad de Sonora. 46 p.
Wikfors, G. H y M. Ohno. 2001. Impact algae research in aquaculture. Journal of Phycology. 37:968-974.