AISLAMIENTO Y CULTIVO DE MICROALGAS BENTÓNICAS DEL CARIBE
COLOMBIANO BAJO DIFERENTES CONDICIONES DE TEMPERATURA
Alix Barreto Hernández y Luz Adriana Velasco
Dirección de los autores:
Laboratorio de Moluscos y Microalgas, Universidad del Magdalena, Carrera 2 No. 18-27, Taganga, Santa Marta, Colombia. Teléfono y fax: 57 5
4219133 (A.B.H.) E-mail: molmarcol@gmail.com (L.A.V.).
Fecha de Recepción: 25/04/2014
Fecha de Aceptación: 22/08/2014
Para citar éste artículo: Barreto, A y L.A, Velasco. 2014. Aislamiento y cultivo de microalgas bentónicas del Caribe Colombiano bajo diferentes condiciones de temperatura. Revista Intropica 9: 23 - 32
RESUMEN
Con el fin de crear una colección de microalgas bentónicas marinas del Caribe colombiano, algunas cepas fueron aisladas y cultivadas bajo diferentes condiciones de temperatura. A partir de muestras de perifiton de placas de PVC colocadas en el intermareal rocoso de Taganga, Santa Marta (Colombia), se evaluó el tipo y número de microalgas aisladas, así como la densidad y la constante de crecimiento relativo (K) de tres de las cepas aisladas bajo tres temperaturas de cultivo (20, 25 y 28 °C). Se mantuvieron condiciones constantes de medio de cultivo F/2 de Guillard, iluminación artificial (1500 lux) y valores iniciales de salinidad de 30‰ y pH de 7,0. Se logró el aislamiento de cinco cepas de microalgas a una temperatura de 20 °C (Cylindrotheca closterium, Komvophoron crassum, Tetraselmis sp. y 2 morfotipos de la familia Bacillariaceae); a 25 y 28 °C ninguna cepa fue obtenida. En la diatomea identificada como Bacillariaceae morfotipo 1, los valores mayores de densidad celular (96,3 x 105 cel.ml-1) y K (1,03 div. día-1), se obtuvieron a temperaturas de 20 y 25 °C, mientras que a 28 °C fue imposible obtener su crecimiento. Contrariamente, en las microalgas Cylindrotheca closterium y Tetraselmis sp., los valores mayores de densidad (2,6 y 7,7 x 105 cel.ml-1, respectivamente) se obtuvieron en el tratamiento de 25 °C, mientras que los mayores valores de K ocurrieron a 28 °C (0,64 y 0,60 div. d-1, respectivamente). Este estudio permitió iniciar un cepario de microalgas bentónicas del Caribe colombiano, así como determinar las temperaturas más apropiadas para el aislamiento microalgal (20 °C) y para la producción de células de Bacillariaceae morfotipo 1, Cylindrotheca closterium y Tetraselmis sp. (25 °C).
PALABRAS CLAVE: Cylindrotheca closterium, Komvophoron crassum, Tetraselmis, fitobentos, perifiton
ISOLATION AND CULTURE OF BENTHIC MICROALGAE FROM THE COLOMBIAN
CARIBBEAN UNDER DIFFERENT TEMPERATURE CONDITIONS
ABSTRACT
In order to create a collection of marine benthic microalgae from the Colombian Caribbean, some strains were isolated and cultured under different temperature conditions. From periphyton samples of PVC plates placed in the rocky intertidal of Taganga, Santa Marta (Colombia), the type and number of isolated species, as well as the density and relative growth constant (K) of three of the isolated strains were assessed under three different temperatures (20, 25 and 28 °C). Constant conditions of culture medium Guillard F/2 (250 ml), artificial light (1500 lux) and initial values of salinity of 30‰ and pH of 7,0 were maintained. Five benthic microalgae strains were isolated at 20 °C (Cylindrotheca closterium, Komvophoron crissum, Tetraselmis sp. and 2 morphotypes de la familia Bacillariaceae); at 25 and 28 °C, none of the strains was obtained. In the diatom identified as Bacillariaceae diatom morphotype 1, the highest values of cell density (96,3 x 105 cells.ml -1) and K (1,03 div.day-1), were obtained at temperatures of 20 and 25 °C, while it was impossible to obtain their growth at 28 °C. Conversely, in the microalgae Cylindrotheca closterium and Tetraselmis sp. higher density values (2,6 and 7,7 x 105 cells ml-1, respectively ) were obtained in the 25 °C treatment, while the highest values of K occurred at 28 °C (0,64 and 0,60 div.d-1, respectively). This study allowed starting a collection of benthic marine microalgae, as well as to determine the most suitable temperatures for the microalgae isolation (20 °C) and cell production of Bacillariaceae morphotype 1, Cylindrotheca closterium and Tetraselmis sp. (25 °C).
KEYWORDS: Cylindrotheca closterium, Komvophoron crassum, Tetraselmis, phytobenthos, periphyton
INTRODUCCIÓN
Existe un creciente interés de los países del Caribe en desarrollar el cultivo de invertebrados marinos nativos de interés comercial, tales como los gasterópodos Strombus gigas y Cittarium pica así como los equinodermos Isostichopus badionotus, Lytechinus variegatus y Tripneustes ventricosus (Lovatelli y Sarkis, 2011). Las fases postlarvales, juvenil y/o adulta de estas especies tienen hábitos alimentarios micrófagos herbívoros y/o detritívoros, por lo que requieren alimentarse de microalgas bentónicas bajo condiciones de laboratorio. No obstante, la disponibilidad de este tipo de cepas en el Caribe es relativamente baja, al igual que los estudios de aislamiento y cultivo de microalgas bentónicas (Almaguer et al., 2004; Prieto et al., 2005). Adicionalmente, en algunos países como Colombia existe una fuerte regulación sobre la introducción de especies foráneas, debido al riesgo que representan para los ecosistemas naturales locales, por lo que debe descartarse la utilización de microalgas bentónicas importadas.
Entre los principales géneros de microalgas bentónicas usados como alimento en acuicultura están Navicula, Amphora, Cylindrotheca, Nitzschia, Cocconeis, Skeletonema, Phaeodactylum (Qi-hua et al., 1997; Hemaiswarya et al., 2011; Araya et al., 2012). En el Caribe se ha reportado la existencia de especies similares como Navicula incerta, (Sánchez-Saavedra, 2006), Cocconeis placentula, Cylindrotheca closterium y Skeletonema costatum (Lozano-Duque et al., 2010), las cuales podrían ser aisladas y cultivadas para ser usadas como alimento vivo en las especies locales.
Entre los factores que más influencian el crecimiento y producción de biomasa microalgal está la temperatura del agua, por lo que ha sido extensamente estudiada (Renaud et al., 2002; Tian et al., 2002; Parker et al., 2007; Raghavan et al., 2008; Adenan et al., 2013; Roleda et al., 2013; Wu et al., 2013). En general, en estos estudios se ha encontrado que el aumento de la temperatura ocasiona un aumento en la tasa de crecimiento hasta su óptimo. Generalmente, la temperatura óptima es superior a la temperatura máxima a la cual se encuentra la microalga en el medio natural (Abalde et al., 1995) y varía según la especie (Laing y Ayala, 1990) y su hábitat (Adenan et al., 2013).
En consideración a lo anterior, resulta fundamental contar con un cepario de microalgas bentónicas marinas que pueda proveer microalgas susceptibles de ser usadas como alimento vivo de especies micrófagas herbívoras de interés en acuicultura, así como conocer los parámetros de cultivo más apropiados para su producción. En el presente estudio se aislaron y cultivaron experimentalmente algunas cepas de microalgas bentónicas nativas del Caribe colombiano bajo diferentes condiciones de temperatura.
MATERIALES Y MÉTODOS
Obtención de muestras
Las muestras fueron recolectadas en el litoral rocoso de Playa Genemaca (74°11'45,67"W, 11°16'4,27"N), ubicada en la bahía de Taganga (Santa Marta, Colombia). El agua de mar costera de la región se caracteriza por tener salinidades que pueden variar entre 30 y 36‰, temperaturas entre 23 y 29 °C (Vivas- Aguas et al., 2012) y pH entre 8,21 y 8,32 (García-Hoyos et al., 2010). Tres placas de PVC (policloruro de vinilo) rectangulares (20 x 22 cm) y provistas de una base de concreto fueron colocadas a 1m de profundidad y perpendiculares al fondo. Entre marzo y agosto de 2012, fueron extraídas quincenalmente y mediante un asa metálica se colectaron dos muestras de perifiton (1-5 mg), tras lo cual, las placas eran reubicadas en el mismo sitio. Posteriormente, cada muestra fue inoculada en un tubo de ensayo (20 ml) con 10ml de medio de cultivo de Guillard F/2 previamente esterilizado (Guillard y Ryther, 1962). Finalmente, los tubos inoculados fueron transportados al Laboratorio de Moluscos y Microalgas de la Universidad del Magdalena en donde se realizó el aislamiento de las especies.
Aislamiento de especies
Con las muestras de perifiton provistas de medio de cultivo se evaluó el tipo y número de especies aisladas bajo tres temperaturas (20, 25 y 28 °C). Para ello, los tubos de ensayo fueron colocados en gradillas plásticas inmersas en baños termoregulados, mantenidos con una iluminación constante (1500 lux) y con valores iniciales de pH de 7,0 y salinidad de 30‰. Diariamente se tomaron tres muestras (1 ml) de cada tubo de ensayo con cultivo primario las cuales se examinaron bajo un microscopio de luz (Marca NIKON Eclipse E100, en aumentos de 40X y 100X) para detectar la presencia de microalgas y se aplicó la técnica de diluciones seriadas de 1:10 a aquellas muestras positivas (Guillard, 1973). Estas diluciones fueron mantenidas en las mismas condiciones de las cuales procedían sus inóculos y fueron sometidos al mismo examen descrito con los cultivos primarios. Los cultivos diluidos positivos fueron usados para aplicar la técnica de rayado en placa (Hoshaw y Rosowski, 1973). Con un asa metálica se tomaron tres muestras de cada cultivo y se sembraron individualmente en cajas Petri con medio de cultivo Guillard F/2 (15ml) y agar (20 g/L de medio). Estos cultivos sólidos se colocaron en la temperatura de la cual procedían y bajo las mismas condiciones ambientales descritas anteriormente. El procedimiento fue repetido por lo menos tres veces usando como inoculo muestras de las diferentes colonias que se desarrollaban en este medio hasta verificar el aislamiento de una sola especie, de acuerdo a la tipificación de la colonia y su verificación bajo el microscopio.
Las microalgas que se lograron aislar fueron mantenidas en medio Guillard F/2 sólido en placas de Petri y líquido en tubos de ensayo en el cepario del Laboratorio de Microalgas bajo las mismas condiciones descritas. A los cultivos en medio sólido se les hizo una renovación mensual del medio, mientras que a los mantenidos en medio líquido esta operación se realizó cada 15 días. Con el fin de lograr la identificación de las microalgas aisladas a nivel de división o phyllum, clase, familia, género o especie, las muestras fueron revisadas al microscopio de luz y de contraste de fase a aumentos entre 10 y 100 X usando para la identificación los textos de Hoek et al. (1995) y Vidal (2010).
Cultivo de microalgas
Con las tres primeras cepas microalgales que lograron aislarse se evaluó el efecto de tres diferentes temperaturas (20, 25 y 28 °C) sobre su cultivo. Cada tratamiento tuvo cuatro réplicas, las cuales consistieron en recipientes de vidrio de 500 ml esterilizados y provistos con el medio Guillard F/2 (250 ml). Estos recipientes fueron mantenidos inmersos en baños termoregulados en condiciones de iluminación artificial de 1500 lux y valores iniciales de salinidad de 30 ± 1‰, pH de 7,0 y una densidad inicial de 0,11 ± 0,02 x 105 cel.ml-1.
Los inóculos de cada tratamiento provinieron de un mismo cultivo, los cuales fueron previamente aclimatados durante tres generaciones a las condiciones experimentales de cada tratamiento de cultivo.
La densidad celular de los cultivos diariamente se cuantificó mediante un hematocitómetro Neubauer, a partir de muestras de 1ml tomadas luego de despegar por agitación las microalgas adheridas a las paredes del recipiente de cultivo. La constante de crecimiento relativo (K) para cada tratamiento se estimó de acuerdo con la ecuación descrita por Fogg (1965). A una de las réplicas de cada tratamiento se le monitoreó diariamente la temperatura (°C), el pH mediante un equipo medidor YSI (precisión 0,1°C y 0,1, respectivamente) y la salinidad con un refractómetro portátil (precisión 1). La intensidad lumínica se midió con un luxómetro L-X- 101 marca Lutron (precisión 1 Lux). Las cepas aisladas se depositaron en la Colección de Microalgas Marinas de la Universidad del Magdalena (UMC-MA, Registro Nacional de Colecciones Biológicas No. 205).
Análisis estadístico
Para analizar el efecto de la temperatura sobre la densidad celular de las diferentes microalgas aisladas, se realizaron análisis de medidas repetidas con el supuesto de esfericidad asumida. Para establecer el efecto de la temperatura y la especie sobre los valores máximos de K se realizaron análisis de varianza factorial seguidos del test de Tukey, previa verificación del cumplimiento de los supuestos de normalidad y homocedasticidad. Los análisis estadísticos se efectuaron mediante el programa estadístico SPSS 20. Para las decisiones se usó un nivel de significancia del 95%.
RESULTADOS
Aislamiento y descripción de microalgas
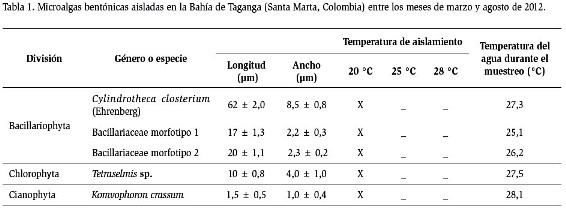
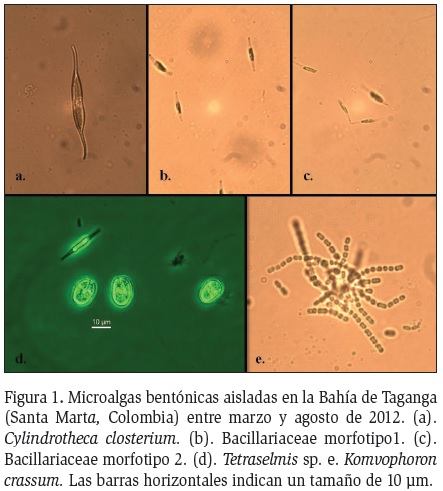
Se aislaron cinco cepas de microalgas bentónicas a 20 °C; mientras que a 25 y 28 °C no se logró aislar ninguna. Tres microalgas pertenecen a la división Bacillariophyta, mientras que las divisiones Chlorophyta y Cyanophyta, estuvieron representadas por una sola especie (Tabla 1). La mayor parte de las microalgas (4/5) presentaron tamaños menores a 20 μm, solo Cylindrotheca closterium presentó un mayor tamaño. Se identificó hasta el nivel de especie a Cylindrotheca closterium y Komvophoron crassum, a nivel de género Tetraselmis y otras dos a nivel de familia (Bacillariaceae). A altas temperaturas se observó la presencia de protozoarios, detrito y colonias bacterianas en los cultivos primarios.
Cultivo de microalgas
Bacillariaceae morfotipo1
Los cultivos que iniciaron con una densidad de 0,10
x 105 cel.ml-1 obtuvieron máximos valores de 96,33
x 105 cel.ml-1 entre el día 9 y 10 (Figura 2a). En el
tratamiento de 28 °C no se logró crecimiento algal
durante la aclimatación ni el experimento. Los valores
de K estuvieron entre 0,99 y 1,03 div.d-1 (Figura 3). El
pH osciló entre 7,8 y 8,6, mientras que la salinidad
se mantuvo entre 30 y 31‰. Los análisis estadísticos
demostraron que la temperatura de cultivo afectó de
forma significativa la densidad celular (gl = 2, F =
308,38, p = 0,000) y los valores de K (gl = 2, F =
1941,06, p = 0,000) de Bacillariaceae morfotipo1. Los
tratamientos de 20 y 25 °C presentaron valores similares
entre ellos (p > 0,05) pero significativamente mayores
que los del tratamiento de 28 °C (p < 0,05).
Cylindrotheca closterium
Los cultivos de Cylindrotheca closterium que iniciaron
con una densidad celular de 0,10 x 105 cel.ml-1,
alcanzaron valores máximos de 2,55 x 105 cel.ml-1 (Figura 2b) entre los días 7 y 9. Los valores de K oscilaron entre
0,32 y 0,64 div.d-1 (Figura 3). El pH osciló entre 7,7 y 8,6,
mientras que la salinidad se mantuvo entre 30 y 32‰.
Los análisis estadísticos mostraron que la temperatura
afectó significativamente la densidad celular (gl = 2, F
= 126,872, p = 0,000) y los valores de K de esta especie
(gl = 2, F=35,94, p = 0,0005). Los mayores valores
de densidad se obtuvieron en el tratamiento de 25 °C,
mientras que los menores se evidenciaron en los cultivos
a 20 °C (p < 0,05). De otro lado, los mayores valores
de K ocurrieron a una temperatura de 28 °C, mientras
que los menores se presentaron en la temperatura de
20 °C (p < 0,05).
Tetraselmis sp.
Los cultivos de Tetraselmis sp. que tenían una densidad
inicial de 0,13 x 105cel ml-1 obtuvieron valores máximos
de 7,66 x 105 cel ml-1 entre los días 9 y 10 del cultivo
(Figura 2c). Los valores de K oscilaron entre 0,52 y 0,60
div.d-1 (Figura 3). El pH del cultivo osciló entre 7,5 y 8,7,
mientras que la salinidad se mantuvo entre 30 y 31‰.
Los análisis estadísticos demostraron que la temperatura
del agua incidió de forma significativa sobre la densidad
celular (gl = 2, F = 168,5, p = 0,000) y sobre K (gl
= 2, F = 8,1, p = 0,019). Los mayores valores de
densidad se presentaron en el tratamiento de 25 °C,
mientras que los menores valores ocurrieron a 28 °C (p
< 0,05). De otro lado, los valores de K fueron mayores
a 28 °C, mientras que los menores se observaron en la
temperatura de 20 °C (p < 0,05).
La especie de microalga presentó una influencia significativa sobre los valores máximos de densidad de los cultivos (gl =8, F =379,16, p = 0,0000), producción de biomasa (gl =2, F =299,57, p = 0,0000) y K de las diferentes microalgas (gl = 8, F =259,7, p =0,0000). Los mayores valores de densidad máxima y K fueron obtenidos con Bacillariaceae morfotipo1 y los menores con Cylindrotheca closterium (Figura 3).
DISCUSIÓN
Las microalgas aisladas e identificadas a nivel de género o especie han sido reportadas para el Caribe colombiano como parte del fitoplancton (Caicedo, 1977; De la Hoz-Aristizabal, 2004; Ramírez-Barón et al., 2010; Vidal, 2010), o del fitobentos (Lozano-Duque et al., 2010). Sin embargo, Tetraselmis sp. no ha sido reportada para el Caribe colombiano, por lo que su presencia en este estudio representa un nuevo reporte para esta zona. El hecho de que las microalgas aisladas estén reportadas tanto en el plancton como en el bentos pone de manifiesto que la separación de las microalgas como bentónicas o planctónicas es relativa, y hay algunas de ellas que pueden estar tanto en la columna de agua como en el bentos. Las microalgas aisladas demostraron tener características necesarias para ser consideradas bentónicas como es la capacidad de fijarse sobre las paredes de los recipientes de cultivo y crecer sobre ellas formando biopelículas. Es posible que estas microalgas tengan la capacidad de seleccionar el hábitat de acuerdo a las condiciones ambientales o que éste varíe dependiendo de la fase de su vida. En los cultivos monoalgales de las especies estudiadas se observa que las células que se encuentran en la columna de agua son más pequeñas que las que están en el fondo, así mismo, que las células que experimentan reproducción mediante fisión binaria tienen inicialmente un menor tamaño. Es posible que las microalgas que hayan experimentado recientemente fisión binaria también sean menos densas y tiendan a formar parte del fitoplancton, mientras que cuando alcanzan mayores tamaños y densidades tiendan a sedimentarse y adherirse al fondo, pasando a ser parte del bentos.
La mayor representación de las diatomeas (División Bacillariophyta) en comparación con las clorófitas y cianófitas dentro de las microalgas aisladas coincidió con resultados obtenidos previamente en estudios de aislamiento llevados a cabo en ambientes marinos (Parodi y Cao, 2003). Este fenómeno parece deberse a que las diatomeas son dominantes en los océanos (Battarbee, 1986), incluyendo la región de Santa Marta (Gocke et al., 2003; Giraldo et al., 2011).
La imposibilidad de aislar microalgas bajo condiciones de media y alta temperatura (25 y 28 °C), sugiere que la baja temperatura fue determinante bajo las condiciones aplicadas. El éxito en el aislamiento de microalgas depende de la capacidad de la misma para diferenciarse de las demás dentro del cultivo inicial mixto, ya sea por su tamaño, resistencia, flotabilidad, abundancia y/o capacidad de crecimiento (Andersen y Kawachi, 2005). Las muestras de perifiton tomadas en el medio natural pudieron contener no solo microalgas sino también bacterias y protozoos. Aparentemente éstos últimos proliferaron en condiciones de las mayores temperaturas probadas (25 y 28 °C), ya que en estas condiciones se verificó su presencia. Los protozoos y bacterias pudieron consumir las microalgas o competir con ellas por nutrientes y espacio, afectando negativamente su concentración en los cultivos mixtos iniciales, como se ha reportado en otros estudios (Riquelme y Avendaño- Herrera, 2003). Contrariamente, en la menor temperatura probada (20 °C), donde no se evidenció crecimiento de estos microorganismos en los cultivos mixtos iniciales, las microalgas pudieron presentar una ventaja competitiva en el uso de los recursos disponibles, lo cual pudo ocasionar un aumento en su densidad y por lo tanto en la probabilidad de ser aisladas. Estos resultados sugieren que para tener éxito en el aislamiento de especies adaptadas a temperaturas de 25 y 28 °C se requiere controlar el rápido crecimiento de bacterias y protozoos que vienen asociados a las muestras de perifiton mediante la purificación de los cultivos, usando antibióticos, químicos y/o centrifugación, como lo describen Hoshaw y Rosowski (1973) para eliminar o matar microorganismos adheridos a las microalgas de interés.
Los mayores valores de densidad registrados por las microalgas bajo condiciones de temperatura intermedia (25 °C), en comparación con temperaturas más altas (28 °C) y/o bajas (20 °C) coinciden con lo encontrado en otros estudios como los realizados con especies como Nannochloropsis strain MFD-2 (James et al., 1989), Cyclotella glomerata (Angarita y Sánchez, 2003), Chlorella sorokiniana (Moronto et al., 2006) y Chlorella sp. (Adenan et al., 2013). El aumento en la temperatura incrementa la tasa metabólica (Adenan et al., 2013) y fotosintética de las microalgas (DeNicola, 1996), debido al aumento en la velocidad de las reacciones intracelulares, dadas por la mayor energía cinética de las moléculas. En estas condiciones, la tasa de crecimiento aumenta, incrementándose también la toma de nutrientes del medio para llevar a cabo los procesos metabólicos (López-Elias, 2002). Valores muy altos de temperatura ocasionan un descenso de la fotosíntesis, debido a un efecto de inhibición en la producción y fotooxidación de los pigmentos (Laing y Helm, 1981). Dado que en esta situación la entrada de nutrientes por la fotosíntesis desciende y el gasto de energía por respiración aumenta, la energía disponible para reproducirse disminuye, y por lo tanto el crecimiento poblacional desciende. Por consiguiente los mayores valores de densidad y biomasa obtenidas en este estudio a 25 °C pudieron ser ocasionados por una mayor eficiencia de la fotosíntesis en la transformación de la luz y nutrientes disponibles en nuevas células.
Los mayores valores de las constantes de crecimiento relativo de las microalgas Cylindrotheca closterium y Tetraselmis sp. bajo condiciones de temperatura de cultivo (28 °C), en comparación con 25 y 20 °C, coinciden con la respuesta reportada para microalgas tropicales como Chaetoceros sp., Cryptomonas (Renaud et al., 2002), Hyaloraphidium contortum y Chlorella vulgaris (Brito et al., 2006), Chaetoceros calcitrans (Adenan et al., 2013) e Isochrysis galbana (Velasco et al., 2009). De otro lado, la ausencia de crecimiento de Bacillariaceae morfotipo 1 bajo condiciones de 28 °C, concuerda con lo encontrado para especies de aguas templadas como Phaeodactylum tricornutum (Jiang y Gao, 2004) y Nitzschia sp. (Joon-Baek y Bo-Young, 2002). Las microalgas tienen rangos de temperatura óptimos diferentes, dependiendo de las condiciones de su hábitat natural (Adenan et al., 2013). Aunque todas las microalgas aisladas procedieron del intermareal rocoso tropical, donde las temperaturas regularmente oscilan entre 26 y 29 °C, la microalga Bacillariaceae morfotipo 1 no exhibió una cinética algal propia de esta zona. Es posible que esto tenga relación con el hecho de que dicha diatomea fue aislada de muestras tomadas en marzo de 2012, época de surgencia, en la cual hay un ascenso de aguas frías y una mezcla con las aguas someras (Ramírez-Barón et al., 2010). Esto sugiere que esta especie es propia de aguas más profundas y frías o que prolifera cuando se dan condiciones de baja temperatura, presentándose temporalmente en zonas someras por efecto de ascenso de aguas profundas y/o enfriamiento asociado al fenómeno de surgencia, como ha sido observado en otros estudios con especies como Berkeleya hyalina (Camacho y Vidal, 2011). En síntesis, las microalgas aisladas mostraron diferentes valores de temperatura para su crecimiento, sugiriendo que C. closterium y Tetraselmis sp. podrían ser especies propias de aguas someras con temperaturas óptimas entre 25 y 28 °C, mientras que Bacillariaceae morfotipo 1 sería propia de aguas más profundas o frías, con temperaturas óptimas entre 20 y 25 °C.
La falta de coincidencia entre la temperatura a la cual se dieron los mayores valores de las constantes de crecimiento K de C. closterium y Tetraselmis sp. (28 °C) y sus mayores producciones de células (25 °C), ha sido reportada previamente para Amphora coffeaeformis (Joon-Baek y Bo-Young, 2002). Esto sugiere que las temperaturas en las cuales estas microalgas presentan una alta tasa reproductiva y por tanto una mejor adaptación (Richmond, 2004), no son en las que transforman más eficientemente los nutrientes y la luz disponibles, es decir en la que se da una mayor eficiencia fotosintética. Contrariamente, en Bacillariaceae morfotipo 1 sí se presentó una coincidencia entre los mayores valores de K y la densidad a una temperatura intermedia de 25 °C, sugiriendo que en estas condiciones tienen una mejor adaptación y eficiencia fotosintética.
Los mayores valores de tasa de crecimiento y producción de células de la microalga más pequeña Bacillariaceae morfotipo 1 en comparación con las microalgas de mayor tamaño, Tetraselmis sp. y Cylindrotheca closterium, coinciden con lo presentado en otros estudios (Fogg, 1965; Porta, 2009). Este fenómeno ha sido explicado por el hecho de que las microalgas de menor tamaño tienen una mayor relación superficie/ volumen que las más grandes, lo que les permite absorber nutrientes a una mayor velocidad (Fogg, 1965). Adicionalmente, es posible que las microalgas más pequeñas tiendan a derivar mayor cantidad de energía a la formación de nuevas células, en lugar de canalizarla hacia la formación de una talla mayor, lo cual explicaría las mayores tasas de crecimiento en densidad de las microalgas pequeñas en comparación a las de tamaño mayor.
En conclusión, se aislaron cinco microalgas bentónicas del Caribe colombiano con potencial para ser producidas y usadas en acuicultura, las cuales permitieron iniciar un cepario de este tipo de microalgas. Se pudo establecer que la temperatura fue muy importante en su aislamiento y cultivo, siendo 20 °C la temperatura más apropiada para lograr el aislamiento y 25 °C para la producción de células. A 28 °C algunas no crecieron o presentaron una tasa de crecimiento muy alta pero rápidamente murieron, presentando valores bajos de producción de células.
AGRADECIMIENTOS
Los autores agradecen el apoyo de Luis Alfonso Vidal y Santiago Fraga Rivas y del personal del Grupo Moluscos Marinos de la Universidad del Magdalena - Colombia. Este trabajo forma parte de los resultados del proyecto Fonciencias 013 del 2011 y del proyecto Colciencias 323-2011.
BIBLIOGRAFÍA
Abalde, J., A. Cid, P. Fidalgo, E. Torres Y C. Herrero. 1995. Microalgas: Cultivo y Aplicaciones. España, Universidad de La Coruña, Monografía No.26, 210 p.
Adenan, N. S., F. Md. Yusoff y M. Shariff. 2013. Effect of salinity and temperature on the growth of diatoms and green algae. Journal of Fisheries and Aquatic Science 8: 397-403.
Almaguer, Y., E. Alfonso y S. Leal. 2004. Aislamiento y cultivo de dos especies de diatomeas bentónicas. Revista de Investigaciones Marinas 25 (1): 57-64.
Andersen, R.A. y M. Kawachi. 2005. Traditional microalgae isolation techniques, 83-100. En: R.A. Andersen, Ed., Algal Culturing Tecniques, Cap. 6, Elsevier Science Publishing, 589 p.
Angarita, C.R. y G.E. Sánchez. 2003. Efecto de la temperatura, salinidad y medio de cultivo en el crecimiento de Cyclotella glomerata (Bacillariophyceae), proveniente de la Ciénaga Grande de Santa Marta, Caribe colombiano. 1-3. En: Universidad Nacional y Universidad de Costa Rica (Eds.). Resúmenes Ampliados. X Congreso Latinoamericano de Ciencias del Mar (X Colacmar). San José, Costa Rica. 42 p.
Araya, R., C. Bahamondes, K. Barahona y F. Silva- Aciares. 2012. Utilización de una biopelícula microalgal multiespecífica para optimizar la fijación larval y el crecimiento de abalón (Haliotis rufescens) en un criadero comercial. Revista de Biología Marina y Oceanografía 45(1): 59-69.
Battarbee, R. W. 1986. Diatom analysis. In Berglund, B. E. (ed.) Handbook of Holocene Palaeoecology and Palaeohydrology. J. Wiley, New York, 527-570 p.
Brito, D., N. Milani, G. Pereira, M. González y R. Morán. 2006. Crecimiento de microalgas de agua dulce, en dos medios de cultivo Guillard y un fertilizante comercial Nitrofoska. Ciencia 14(4): 397-410.
Caicedo, I. E. 1977. Fitoplancton de la bahía de Neguange (Parque Nacional Tayrona), mar Caribe, Colombia. Anales del Instituto de Investigaciones Marinas y Costeras de Punta Betín 9: 17-44.
Camacho, O. y L.A. Vidal. 2011. Nuevos registros de diatomeas marinas formadoras de tubos en el Caribe colombiano. Boletín de Investigaciones Marinas y Costeras 40(2): 437-444.
De la Hoz-Aristizábal, M.V. 2004. Dinámica del fitoplancton de la ciénaga grande de Santa Marta, Caribe colombiano. Boletín de Investigaciones Marinas y Costeras 33(1): 159- 179.
DeNicola, D.M. 1996. Periphyton responses to temperature at different ecological levels. 150-166. En: Stevenson, R.J., M.L. Bothwell, R.L. Lowe (Eds) Algal ecology, freshwater benthic ecosystems. San Diego, California. 749 p.
Fogg, G. E. 1965. Algal cultures and phytoplankton ecology. University of Wisconsin press, Londres. 175 p.
García-Hoyos, L. M., A. Franco-Herrera, J. S. Ramírez-Barón y D. A. López-Cerón. 2010. Dinámica océano-atmosfera y su influencia en la biomasa fitoplanctónica, en la zona costera del departamento del Magdalena, Caribe colombiano. Boletín de Investigaciones Marinas y Costeras 39(2): 307-335.
Giraldo, A., B. Valencia y D. Ramírez. 2011. Productividad planctónica y condiciones oceanográficas locales en la isla Gorgona durante Julio del 2006. Boletín de Investigaciones Marinas y Costeras 40(1):185-201.
Gocke, K., M. Meyerhofer, J.E. Mancera y L.A. Vidal. 2003. Phytoplankton composition in coastal lagoons of different trophics status in Northern Colombia determined by microscope and HPLC-pigment analydis. Boletín de Investigaciones Marinas y Costeras 32:263-278.
Guillard, R.R.l. 1973. Methods for microflagellates and nannoplankton 69-85. En: Stein, J.R. (Ed) Handbook of Phycological Methods. Culture Methods and Growth Measurements. London: Cambridge University Press, Nueva York. 405 p.
Guillard, R.R.L. y J.H. Ryther. 1962. Studies on marine planktonic diatoms: I. Cyclotella nana Hustedt, and Detinula conferacea (Cleve). Canadian journal of microbiology 18: 229-239.
Hemaiswarya, S., R. Raja, R. Ravi Kumar, V. Ganesan y C. Anbazhagan. 2011. Microalgae: a sustainable feed source for aquaculture. World Journal of Microbiology and Biotechnology 27:1737–1746.
Hoek, C., D.G. Mann y H.M. Jahns. 1995. Algae: an introduction to phycology. Cambridge University Press. 348 p.
Hoshaw, R. W. y J. R. Rosowski. 1973. Methods for microscopic algae. 53-67. En: Stein, J. R. (Ed.) Handbook of phycological Methods, Culture Methods and Growth Measurements. London: Cambridge University Press, Nueva York. 446 p.
James, C. M., S. Al-Hinty y A. E. Salman. 1989. Growth and ω3 fatty acid and amino acid composition of microalgae under different temperature regimes. Aquaculture 77: 337-351.
Jiang, H. y K. Gao. 2004. Effects of lowering temperature during culture on the production of polyunsaturated fatty acids in the marine diatom Phaeodactylum tricornutum (Bacillariophyceae). Journal of Phycology 40: 651-654.
Joon-Baek, L. y K. Bo-Young. 2002. Growth characteristics of five microalgal species isolated from Jeju Island and four microalgal stock strains in hatchery. Algae 17(2): 117-125.
Laing, I. y F. Ayala. 1990. Commercial mass culture techniques for producing microalgae. pp. 447-477. En: Akatsuka, I. (Ed). Introduction to applied phycology. SPB Academic Publishing Bv., La Haya. 683 p.
Laing, I. y M.M. Helm. 1981. Factors affecting the semicontinuous production of Tetraselmis suecica. Aquaculture 22: 137-148.
López-Elías J.A. 2002. Evaluación cuantitativa y cualitativa de los sistemas de producción de microalgas de seis laboratorios comerciales del Noroeste de México. Tesis Doctoral en Ciencias Marinas, Universidad de Colima, Colima, México. 128 p.
Lovatelli, A. y S. Sarkis. 2011. A regional shellfish hatchery for the Wider Caribbean: Assessing its feasibility and sustainability. FAO Regional Technical Workshop. 18- 21 October 2010, Kingston, Jamaica. FAO Fisheries and Aquaculture Proceedings. No. 19. Rome, 246 p.
Lozano-Duque, Y., L. A. Vidal y G.R. Navas. 2010. Listado de diatomeas (Bacillariophyta) registradas para el mar Caribe colombiano. Boletín de Investigaciones Marinas y Costeras 39 (1): 83-116.
Moronto, R., E. Morales y R. M. Valverde. 2006. Respuesta de la microalga Chlorella sorokiniana al pH, salinidad y temperatura en condiciones axénicas y no axénicas. Revista de la Facultad de Agronomía de La Universidad del Zulia 23(1): 27-41.
Parker, F., M. Davidson, K. Freeman, S. Hair y S. Daume. 2007. Investigation of optimal temperature and light conditions for three benthic diatoms and their suitability to commercial scale nursery culture of abalone (Haliotis laevigata). Journal of Shellfish Research 26(3): 751-761.
Parodi, E. y S. Cao. 2003. Benthic microalgal communities in the inner part of the Bahía Blanca estuary (Argentina): a preliminary qualitative study. Oceanológica 25: 279-284.
Porta, V. A. 2009. Optimización del cultivo de diatomeas bentónicas para el cultivo de post-larvas de abalón (haliotis tuberculata coccinea Reeve, 1846). Instituto Canario de Ciencias Marinas (ICCM) de Las Palmas de Gran Canaria, España. 126 p.
Prieto, M., M. Mogollón, A. Castro y L.A. Sierra. 2005. Efecto del medio y condiciones de cultivo en la productividad de tres diatomeas marinas con potencial acuícola. Revista Medicina Veterinaria y Zootecnia 10 (1): 544-544.
Qi-hua, W., W. Shu-hong, D. Ming-jin, L. Mei, S. Ruo-fu y C. Ai-hua. 1997. Studies on culture conditions of benthic diatoms for feeding abalone" i.effects of temperature and light intensity on growth rate. Chinese Journal of Oceanology and Limnology 15(4): 296-303.
Raghavan, G., C. Kesavan-Haridevi y C. P. Gopinathan. 2008. Growth and proximate composition of the Chaetoceros calcitrans f. pumilus under different temperature, salinity and carbon dioxide levels. Aquaculture Research 39: 1053-1058.
Ramírez-Barón, J. S., A. Franco-Herrera, L. M. García- Hoyos y D. A. López. 2010. La comunidad fitoplanctónica durante eventos de surgencia y no surgencia, en la zona costera del departamento del Magdalena, Caribe colombiano. Boletín de Investigaciones Marinas y Costeras 39(2): 233-263.
Renaud, S. M., L. van Thinh, G. Lambrinidis y D. L. Parry. 2002. Effect of temperature on growth, chemical composition and fatty acid composition of tropical Australian microalgae grown in batch cultures. Aquaculture 211: 195-214.
Richmond, A. 2004. Handbook of microalgal culture: biotechnology and applied phycology. Blackwell Science, Oxford. 566 p.
Riquelme, C. E y R. E. Avendaño-Herrera. 2003. Microalgae and bacteria interaction in the aquatic environment and their potential use in aquaculture. Revista Chilena de Historia Natural 76 (4): 725-736.
Roleda, M. Y., S. P. Slocombe, R. J. Leakey, J. G. Day, E. M. Bell y M. S. Stanley. 2013. Effects of temperature and nutrient regimes on biomass and lipid production by six oleaginous microalgae in batch culture employing a two-phase cultivation strategy. Bioresource Technology 129: 439-449.
Sánchez-Saavedra, M. P. 2006. The effect of cold storage on cell viability and composition of two benthic diatoms. Aquacultural Engineering 34: 131-136.
Tian, Y., Z. Mingjiang y Q. Peiyuan. 2002. Combined effects of temperature, irradiance and salinity on growth of diatom Skeletonema costatum. Chinese Journal of Oceanology and Limnology 20 (3): 237-243.
Velasco, L., J. Barros-Gómez, G. Ospina-Salazar y C. Trujillo. 2009. Efecto de la intensidad lumínica, temperatura y salinidad sobre el crecimiento de la microalga Isochrysis galbana (clon T-ISO). Revista Intropica 4: 93-99.
Vidal, L.A. 2010. Manual del fitoplancton hallado en la Ciénaga Grande de Santa Marta y cuerpos de aguas aledaños. Fundación Universidad de Bogotá Jorge Tadeo Lozano, 348 p.
Vivas-Aguas, L. J., L. Espinosa, J. Sánchez, B. Cadavid. P. Bautista, M. Quintero, J. Betancourt, J.P. Parra, L.G. Parra, I. Cuadrado, K. Ibarra. 2012. Diagnóstico y evaluación de la calidad ambiental marina en el Caribe y pacífico colombiano. Red de vigilancia para la conservación y protección de las aguas marinas y costeras de Colombia- REDCAM. Informe técnico 2012. INVEMAR. Santa Marta, 310 p.
Wu, L. F., P. C. Chen y C. M. Lee. 2013. The effects of nitrogen sources and temperature on cell growth and lipid accumulation of microalgae. International Biodeterioration and Biodegradation 85: 506-510.