GLUCOSA 6 FOSFATO DESHIDROGENASA EN INDÍGENAS PIAROAS EN ZONA ENDÉMICA DE MALARIA
GLUCOSE 6-PHOSPHATE DEHYDROGENASE ON INDIAN PIAROAS IN MALARIA-ENDEMIC AREA
TÍTULO CORTO: GLUCOSA 6 FOSFATO DESHIDROGENASA EN INDÍGENAS PIAROAS
RESUMEN
La Glucosa-6-fosfato deshidrogenasa (G6PD) mantiene intactos los grupos sulfidrilos y ayuda en la detoxificación de radicales libres y peróxidos, por tanto, el déficit provoca daño oxidativo irreversible y destrucción de los eritrocitos cuando estos son sometidos a sustancias oxidativas y al estrés. La infección por Plasmodium spp., produce anemia como consecuencia de la ruptura del eritrocito por parte de este parásito, misma que puede verse agravada en personas infectadas con deficiencia de G6PD al ser expuestos a drogas. Estudio de campo y descriptivo en que se determinó por pruebas bioquímicas la actividad enzimática de G6PD en una comunidad de indígenas Piaroa del municipio Atures, estado Amazonas. La muestra estuvo conformada por 186 individuos, 100 mujeres y 86 hombres. La concentración promedio de hemoglobina fue de 10,6 g/dL, 88,6% de los sujetos resultaron con anemia moderada y ninguno presento deficiencia de G6PD. Se concluye que la anemia es común en indígenas Piaroas, de tipo moderada y carencial; que por prueba bioquímicas no se detecta deficiencia de G6PD; y que este estudio provee información útil a los organismos del Estado encargados de administrar los cuidados de la salud en Venezuela.
Palabras Clave: Anemia; Glucosa-6-fosfato deshidrogenasa; Indígena; paludismo.
ABSTRACT
Glucose-6-phosphate dehydrogenase (G6PD) remains intact sulfhydryl groups and assist in the detoxification of free radicals and peroxides, therefore deficit irreversible oxidative damage and destruction of the erythrocyte when these are subjected to oxidative substances and stress. Plasmodium spp. infection causes anemia as a result of the rupture of the erythrocyte by this parasite, it can be aggravated in people infected with G6PD deficiency when exposed to drugs. Descriptive field study in which the enzymatic activity of G6PD in an indigenous community of Piaroa municipality of Atures, Amazonas state, was determined by biochemical tests. The sample consisted of 186 individuals, 100 women and 86 men. The average concentration of hemoglobin was 10.6 g/dL, 88, 6% of the subjects were moderately anemic and none had G6PD deficiency. It is concluded that anemia is common in indigenous Piaroas, moderate and deficiency type; no biochemical test that G6PD deficiency is detected; and that this study provides useful information to state agencies responsible for administering health care in Venezuela information.
Keywords: Anemia; glucose 6-phosphate dehydrogenase; Indian; malaria
INTRODUCCIÓN
El papel de la Glucosa-6-fosfato deshidrogenasa (G6PD) en el eritrocito es metabólico, por su potencial reductivo sobre la nicotinamida adenina dinucléotido fosfato (NADP) y generación de NADPH, para mantener intactos los grupos sulfidrilos y ayudar en la detoxificación de radicales libres y peróxidos. Por tanto, el déficit en algunas de sus variantes, provoca daño oxidativo irreversible y destrucción del eritrocito cuando estos son sometidos a sustancias oxidativas y al estrés (daño que puede manifestarse en cualquiera de estas tres formas clínicas: anemia hemolítica aguda, anemia hemolítica no esferocítica y anemia hemolítica neonatal), puesto que las personas que portan este defecto normalmente no son anémicas y son asintomáticas hasta el momento en que sus eritrocitos se exponen a las circunstancias antes mencionadas1-7.
La infección por Plasmodium spp., produce en la persona afectada anemia como consecuencia de la ruptura del eritrocito por parte de este parásito, misma que puede verse agravada en personas infectadas con deficiencia de G6PD al ser expuestos a drogas en dosis convencional, como cloroquina y primaquina, que son utilizadas con frecuencia y de forma masiva en los programas de salud de los países para atender el paludismo en zonas endémicas, entre ellos Venezuela, que adopta esta política anti-paludismo desde 1936 con la Ley de Defensa contra el Paludismo (Gaceta Oficial Nº 19005) que establece la normativa legal del programa de control de esta importante parasitosis7-10.
Por tanto, un importante aspecto a considerar en estudios genéticos por el agravamiento de la hemolisis de eritrocitos, y en consecuencia del grado de anemia, es la determinación poblacional de G6PD en el tratamiento del paludismo, respecto a la posibilidad de aumento de la dosis o la prolongación del número de días de tratamiento en los casos de resistencia o recidiva, particularmente porque el descubrimiento de hemólisis en hombres con deficiencia de G6PD como resultado de tratamiento antimalárico con primaquina data de 1950, y especialmente cuando en 2016 se publica una prevalencia de 3,5% de deficiencia de G6PD en zonas venezolanas (Bolívar y Amazonas) endémicas de paludismo, en que se excluye a la población indígena por considerar escaso su flujo génico11-18.
En este sentido, en Venezuela, de Acquatella desde 196619 no encuentra deficiencia de G6PD en indígenas paraujanos (de la Guajira venezolana), pero debido a la inesperadas cifras de sujetos con anemia hemolítica aguda en indígenas yanomamo (de las comunidades de Ocamo y Mavaca del estado Amazonas), poblaciones con amplia exposición a infección por paludismo y alta prevalencia de síndrome de esplenomegalia hiperactiva a Plasmodium spp., se llevan a cabo estudios para indagar la etiología de estos inusuales casos de anemia hemolítica severa, en que se demuestra que la condición hemolítica está asociada a aglutinación mediada por repuesta autoinmune y no a defectos hereditarios de membrana de eritrocitos, hemogloginopatías o deficiencia de G6PD u otras anormalidades enzimáticas asociadas con hemólisis20-22.
Los problemas de anemia son también evidentes en la población indígena Piaroa del estado Amazonas, en Venezuela, pues se reportan cifras de hasta 89,6% en asociación con infección por Plasmodium spp. de hasta 53,2% (por técnicas de biología molecular), pero en la misma población y a pesar del riesgo de agravarse la anemia con la instauración del tratamiento convencional contra el paludismo, no se realizan estudios para determinar la actividad de G6PD, sin considerar el hecho de que se trata de una población parcialmente incorporada al mismo nivel de desarrollo alcanzado por el resto del país, ubicada en las proximidades de un centro poblado, que ha adoptado algunas de las costumbres urbanas, que forma parejas con sus pobladores citadinos, y que preserva al mismo tiempo sus tradiciones y costumbres ancestrales23, de esto se desprende el objetivo del presente estudio, es decir, la determinación de G6PD en una comunidad Piaroa del estado Amazonas expuesta a transmisión de paludismo.
MATERIALES Y MÉTODOS
Población y muestra
Estudio de campo y descriptivo en que se determinó la actividad enzimática de G6PD en una comunidad de indígenas iaroas llamada Betania del Topocho, perteneciente al municipio Atures del estado Amazonas, ubicada a 50 kilómetros al norte de Puerto Ayacucho, la capital del Estado. Al momento del estudio, la comunidad estuvo constituida por 500 individuos que viven en casas distintas, a diferencia de otros grupos de Piaroas que viven en la tradicional casa comunal. La comunidad cuenta con agua, electricidad, ambulatorio rural y escuela básica como servicios mínimos. La muestra quedó conformada por 86 hombres y 100 mujeres.
Colección de la muestra de sangre
Antes de la toma de muestra y con la participación de intérpretes se obtuvo el consentimiento informado de cada sujeto, previa explicación de los objetivos de la investigación, así como también de los padres o guardianes legales de los menores que participaron en el estudio. Posterior a la realización de la historia clínica y examen físico se obtuvo de cada persona entre 2-3 mL sangre, mediante venopunción de vaso sanguíneo braquial con jeringa estéril.
Determinación de hemoglobina y hematocrito
Las muestras de sangre fueron transferidas a tubos de ensayo con 1,5 mg del anticoagulante EDTA. Una alícuota de 20 μL se utilizó para la estimación del nivel de hemoglobina por el método de la cianometahemoglobina y en la determinación del hematocrito se usaron tubos de microhematocrito sin heparinizar, la centrifugación se realizó en centrífuga ad-hoc, a 12.000 rpm durante 5 minutos, las lecturas se efectuaron en ábaco de cursor móvil24. Finalmente, el resto de las muestras sanguíneas, en dos alícuotas iguales, se almacenaron a –80ºC hasta hacerse los estudios bioquímicos y para posterior confirmación de los resultados obtenidos.
Determinación de actividad enzimática por prueba cualitativa
Se realizó a todas las muestras la prueba de la “mancha fluorescente” por ser la recomendada por el Comité Internacional para la Estandarización en Hematología, por económica, sencilla en su ejecución y relativamente expedita y por tanto útil para los estudios de masas25,26.
Dentro de un tubo de ensayo (13x100 mm) etiquetado como muestra, se añadió 100 μL de la solución substrato de G6PD (contiene para cada mL; 200 μL de G6P [10 mmol/L], 100 μL de β-NADP [7,5 mmol/L], 200 μL saponina [10g/L], 100 μL glutatión oxidado [8 mmol/L] y 300 μL buffer Tris-HCl pH 7,8 [750 mmol/L]) y 10 μL de sangre y sometida previamente a tres lavados con solución fisiológica y cuidadosa remoción del plasma. Se mezcló y se transfirió a los cinco y diez minutos una gota de la mezcla a papel de filtro (Whatman No. 1), periodo en el cual se produce incremento constante de la producción de NADPH. Para cada muestra se identificaron las manchas en el papel de filtro como tiempos de reacción a los cinco y diez minutos.
El tubo etiquetado como muestra se colocó en baño de María a 37°C, igual procedimiento se siguió para los controles. Todos los reactivos utilizados en el ensayo fueron adquiridos de la casa SIGMA-ALDRICH® (Estados Unidos) y utilizados según las indicaciones del fabricante. Se realizó inspección visual de la fluorescencia de la mancha bajo luz ultravioleta (460 nm), con lámpara de luz UV, de longitud de onda larga (Cole Palmer®, Estados Unidos) y a través de cabina de protección UV (Chromato-Vue® Cabinet, UVP. INC, Estados Unidos). Todas las reacciones se hicieron por triplicado. La prueba se leyó como actividad normal de la G6PD cuando se observó fluorescencia a los cinco y a los diez minutos. Se consideró como deficiencia intermedia si la fluorescencia solo se evidencia a los diez minutos. La fuerte deficiencia de G6PD implicó ausencia de fluorescencia a los cinco y diez minutos.
Determinación de la actividad enzimática por prueba cuantitativa
Se aplicó a todas las muestras la prueba cuantitativa espectrofotométrica, que tiene una sensibilidad de 97% y permite agrupar las deficiencias en clases27-29. Se utilizó un método espectrofotométrico comercial (NeoLiSA G6PD assay, INTERSCIENTIFIC®, Hollywood, Estados Unidos) basado en la oxidación de la G6P a 6 FG y en la reducción de NADP a NADPH a 37ºC.
La cantidad de NADPH se midió espectrofotométricamente a 570 nm con un espectrofotómetro Titertek Multiskan® (Phoenix Equipment Inc, Estados Unidos). Las mediciones se efectuaron cada minuto durante diez minutos, pues la producción de NADPH incrementa linealmente durante los primeros diez minutos y se iguala después de este lapso. Una unidad de actividad se definió como la cantidad de G6PD (0,6μg) que puede convertir 1 μmol de G6P a 6 FG por minuto, en presencia de NADP, a pH de 7,4 y 37ºC, de manera tal que por cada mol de G6P oxidada se genere un mol de NADPH30,31. La actividad enzimática se determinó según la concentración de hemoglobina.
Análisis estadístico
Se realizaron estadísticas descriptivas y la prueba j cuadrado (X2) aplicada a tablas de contingencia 2X2 para determinar que las diferencias entre las muestras se deban o no al azar.
Declaración de aspectos éticos
Se obtuvo el consentimiento informado de cada sujeto y aprobación por el Comité de Bioética del Instituto Venezolano de Investigaciones Científicas (IVIC), Caracas, Venezuela, con base en la Declaración de Helsinki.
RESULTADOS
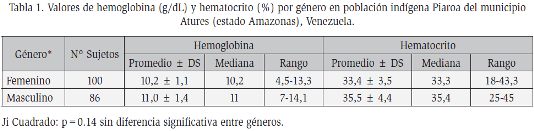
La muestra estuvo conformada por 186 individuos, 100 mujeres y 86 hombres (sin diferencia significativa entre géneros p=0.14), cuya edad promedio fue de 20,7 ± 19,3 años. La concentración promedio de hemoglobina fue de 10,6 g/dL, con desviación estándar de 1,3 y el hematocrito de 34,4%, con desviación estándar de 4,1. Al discriminar por género la concentración de hemoglobina esta fue de 10,52 ± 1,1 g/dL para las mujeres y 11,0 ± 1,4 g/dL en los hombres y el hematocrito 33,4 ± 3,5% para las primeras y de 35,5 ± 4,4% para los segundos (Tabla 1).

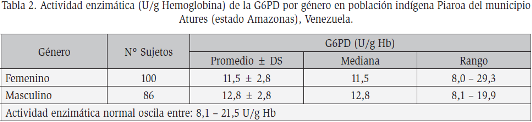
Resultaron con anemia moderada 88,6% de los individuos de la muestra, además todos los sujetos estudiados resultaron sin deficiencia de G6PD por prueba cualitativa y cuantitativa, y la actividad enzimática promedio en ellos fue de 12,1± 2,8 U/g Hb. Al segregar por género no se observó diferencia en la actividad de la enzima, al respecto la actividad enzimática fue de 11,5 ± 2,8 U/g Hb en las mujeres y de 12,8 ± 2,8 U/g Hb en los hombres (Tabla 2).
DISCUSIÓN
La amplia distribución en el mundo de la deficiencia de G6PD, aunado a su significado clínico y a su importancia para el manejo de la anemia, implican la necesidad de emprender estudios epidemiológicos que permitan obtener indicadores de dicha deficiencia en las regiones con mayor riesgo de transmisión de Plasmodium spp., debido a los frecuentes reportes de hemólisis intravascular, en individuos portadores de esta deficiencia genética que reciben droga antipalúdica, estudios que cobran vital importancia en poblaciones donde se desconoce el grado de mezcla genética, como sucede con los indígenas Piaroas, quienes se han abierto en sus relaciones personales al resto de la población venezolana en que se ha evidenciado la mezcla génica de tipo africana, europea y amerindia, aunque poco se sabe sobre la forma e intensidad como se dio el mestizaje en diferentes regiones del país32-34.
La elevada prevalencia de anemia moderada que se reporta en más de un tercio de la población de indígenas Piaroa estudiada puede deberse a carencias alimentarias, como la deficiencia de hierro, ácido fólico y vitamina B12 reportadas en Venezuela (para la misma comunidad Piaroa y para comunidades indígenas yucpa en el occidente del país con hasta 71% de la población afectada por anemia) y otros países23,35,36, más que por hemolisis intravascular por deficiencia de G6PD, pues ninguno de los participantes resultó con deficiencia para G6PD por pruebas bioquímicas (incluso los infectados con Plasmodium spp. que estaban recibiendo tratamiento convencional anti Plasmodium spp.), entonces la imposibilidad para acceder a alimentos variados derivada de su precaria situación económica y sus prácticas religiosas y culturales pueden ser la causa básica de la anemia del indígena Piaroa.
Sin embargo, es posible que en la muestra estudiada hubiera mujeres portadoras de la deficiencia en heterocigosis, que posiblemente no fueran descubiertas con las pruebas bioquímicas, pues el desbalance en la inactivación del cromosoma X puede enmascarar las deficiencias de la actividad enzimática, por lo que se hace imprescindible realizar detección por biología molecular de la mutación genética, prueba de mayor especificidad y sensibilidad, pero costosa para estudios poblacionales37,38. Ahora bien, si la mezcla génica fuera efectiva entre indígenas Piaroas e individuos de las ciudad (que la población indígena este integrada a la mestiza urbana y no aislada o desplazada), es de esperar deficiencia bioquímica de G6PD clase III, la que caracteriza a la población venezolana y que se corresponde con individuos con deficiencia enzimática de leve a moderada, en los cuales la sintomatología hemolítica es desencadenada únicamente por la exposición a sustancias que inducen estrés oxidante18,39,40.
Con lo hallado en esta investigación se confirma la tendencia que muestran los análisis de variantes genéticas (polimorfirmos) de grupos sanguíneos y proteínas (principalmente), que en Venezuela, al igual que otros países latinoamericanos, es definitorio que las poblaciones sean bastante heterogéneas como resultado de los patrones de conquista y colonización, pues es muchos subgrupos poblacionales se evidencia la característica complejidad (respecto a la participación cuantitativa de los grupos étnicos y en la forma y dirección en que ocurrió el flujo de genes) que involucra la conformación y desarrollo histórico de los pueblos41-47.
CONCLUSIÓN
Finalmente se concluye que la anemia es común en indígenas Piaroas, de tipo moderada y carencial; sin embargo, las pruebas bioquímicas realizadas no detectaron deficiencia de G6PD; y que debido a que la determinación de la deficiencia de G6PD no es una práctica común en los servicios de salud pública del país, este estudio provee información útil a los organismos del Estado encargados de administrar los cuidados de la salud en Venezuela.
AGRADECIMIENTOS
Este estudio fue parcialmente financiado por el Programa Alma Mater de la oficina de planificación del Sector Universitario (OPSU) y por fondos del Instituto Venezolano de Investigaciones Científicas (IVIC). Todas las pruebas realizadas en esta investigación cumplieron a cabalidad con las leyes de Venezuela y fueron aprobadas por el Comité de Bioética del IVIC
DECLARACIÓN SOBRE CONFLICTO DE INTERESES
Los autores declaran que no existe ningún conflicto de interés.
REFERENCIAS BIBLIOGRÁFICAS
1. WHO. Scientific group on the standardization of procedures for the study of glucose – 6 – phosphate dehydrogenase. Geneva: WHO Tech. Rep. Ser. Nº. 366;1967.
2. Yoshida A, Beutler E, Motulsky A. Human G6PD variants. Bull WHO. 1971; 45(2):243-53.
3. Beutler E. The genetics of glucose – 6 - phosphate dehydrogenase deficiency. Semin Hematol. 1990; 27:137-64.
4. Beutler E. Glucose-6-phosphate dehydrogenase deficiency: a historical perspective. Blood. 2008; 111:16–24.
5. Warny M, Lausen B, Birgens H, Knabe N, Petersen J. Severe G6PD Deficiency Due to a New Missense Mutation in an Infant of Northern European Descent. J Pediatr Hematol Oncol. 2015; 37(8):e497-9.
6. Cherepnalkovski A, Zemunik T, Glamocanin S, Piperkova K, Gunjaca I, Kocheva S, et al. Molecular Characterization of Glucose-6-phosphate Dehydrogenase Deficiency in Families from the Republic of Macedonia and Genotype-phenotype Correlation. Med Arch. 2015; 69(5):284-8.
7. Brewer G, Tarlov A, Alving A. The methaemoglobin reduction test for primaquine type sensitibity of erythocytes. JAMA. 1962; 180:386-8.
8. WHO. World malaria report 2014. Geneva: World Health Organization; 2014. [Consultado 2015 Nov 25]. Disponible en: http://www.who.int/malaria/ publications/world_malaria_report_2014/en/.
9. Venezuela. Ministerio de Sanidad y Asistencia Social. Ley de defensa contra el paludismo por la cual se dictan disposiciones en materia de extinción del paludismo por considerarse un problema nacional de salud pública. Gaceta Oficial de los Estados Unidos de Venezuela, 19005 (Jul 11 1936). Disponible en: http://sefar.gob. ve/legalpdf/2.pdf.
10. WHO Working Group. Glucose-6-phosphate dehydrogenase deficiency. Bull World Health Organ. 1989; 67:601-11.
11. Liu H, Tekwani B, Nanayakkara N, Walker L, Doerksen R. Methemoglobin generation by 8-aminoquinolines: effect of substitution at 5-position of primaquine. Chem Res Toxicol. 2013; 26(12):1801-9.
12. Schmidt L, Fradkin R, Genther C, Hughes S. III. Delineation of potential of primaquine as radical curative and prophylactic drug. Am J Trop Med Hyg. 1982; 31(1):646-65.
13. Warhust D. Why are primaquine and ohter 8-aminoquinelines particulary effective against the nature gametocytes and the hypnozoites of malaria? Ann Trop Med Parasitol. 1984; 78(2):165.
14. Yuan L, Wang Y, Parker D, Gupta B, Yang Z, Liu H, et al. Therapeutic responses of Plasmodium vivax malaria to chloroquine and primaquine treatment in northeastern Myanmar. Antimicrob Agents Chemother. 2015; 59(2):1230-5.
15. Von Seidlein L, Auburn S, Espino F, Shanks D, Cheng Q, McCarthy J, et al. Review of key knowledge gaps in glucose-6-phosphate dehydrogenase deficiency detection with regard to the safe clinical deployment of 8-aminoquinoline treatment regimens: a workshop report. Malar J. 2013; 12:112.
16. Baird K. Origins and implications of neglect of G6PD deficiency and primaquine toxicity in Plasmodium vivax malaria. Pathog Glob Health. 2015; 109(3):93-106.
17. Howes R, Dewi M, Piel F, Monteiro W, Battle K, Messina J, et al. Spatial distribution of G6PD deficiency variants across malaria-endemicregions. Malar J. 2013; 12:418.
18. Vizzi E, Bastidas G, Hildalgo M, Colman L. Pérez H. Prevalence and molecular characterization of G6PD deficiency in two Plasmodium vivax endemic areas in Venezuela: predominance of the African A202A/376G variant. Malar J. 2016; 15(1):19.
19. Acquatella G. Deficiencia de glucosa-6-fosfato deshidrogenasa en diferentes grupos raciales de Venezuela. Acta Cient Venez. 1966; 17:127.
20. Torres J, Noya O, Mondolfi A, Alarcon B, Botto C, Peceño C. Hyperreactive malarious splenomegaly in Venezuela: a field study. Am J Trop Med Hyg. 1985; 1:1-3.
21. Torres J, Mondolfi A. Protracted outbreak of severe delta hepatitis: experience in an isolated Ameridian population of the upper Orinoco Basin. Rev Infec Dis. 1991; 13:52-5.
22. Torres J, Magris M, Villegas L, Torres M, Domínguez G. Spur cell anaemia and acute haemolysis in patients with hyperreactive malarious splenomegaly. Experience in an isolated Yanomamo population of Venezuela. Acta Trop. 2000; 77:257-62.
23. García-Casal M, Leets I, Bracho C, Hidalgo M, Bastidas G, Gomez A, et al. Prevalence of anemia and deficiencies of iron, folic acid and vitamin B12 in an Indigenous community from the Venezuelan Amazon with a high incidence of malaria. Arch Latinoam Nutr. 2008; 58(1):12-8.
24. International committee for standardization in haematology. Recomendations for reference method for haemoglobinometry in human blood and specifications for international haemiglobicyanide reference preparation. J Clin Path. 1977; 31: 139-43.
25. Beutler E, Blume K, Kaplan C, Lohr W, Ramot B, Valentnine W. International committee for standardization in haematology: recommended screening test for glucose6-phosphate dehydrogenase (G-6-PD). Br J Haematol. 1979; 43:469-77.
26. Iwai K, Matsuoaka H, Kawamoto F, Arai M, Yoshida S, Hirai M, et al. A rapid single-step screening method for glucose-6-phosphate dehydrogenase deficiency in field applications. Jpn J Trop Med Hyg. 2003; 31:93-7.
27. Wolf B, Weening R, Schutgens R, Van Noorden C, Vogels I, Nagelkerke N. Detection of glucose-6phosphate dehydrogenase deficiency in erythrocytes: a spectrophotometric assay and a fluorescent spot test compared with a cytochemical method. Clin Chim Acta. 1987; 168:129-36.
28. Chen E, Chang A, Lee A, Kuang W, Hillier L. Sequence of human glucose-6-phosphate dehydrogenase cloned in plasmids and a yeast artificial chromosome (YAC). Genomics. 1992; 10:792-800.
29. Cappellini M, Fiorelli G. Glucose-6-phosphate dehydrogenase deficiency. Lancet. 2008; 371:64-74.
30. Au S, Gover S, Lam S, Adams M. Human glucose-6phosphate dehydrogenase: the crystal structure reveals a structural NADP(+) molecule and provides insights into enzyme deficiency. Struct Fold Des. 2000; 8:293-303.
31. Mesner O, Hammerman C, Goldschmidt D, Rudensky B, Bader D, Kaplan M. Glucose-6-phosphate dehydrogenase activity in male premature and term neonates. Arch Dis Child Fetal. 2004; 89:555-7.
32. Santos J, Pérez F, Carrasco E, Albala C. Use of caseparents trio for epidemiological studies of association between genetic polymorphisms and complex diseases. Rev Med Chil. 2002; 130:1307-15.
33. Amos W, Driscoll E, Hoffman J. Candidate genes versus genome-wide associations: which are better for detecting genetic susceptibility to infectious disease? Proc Biol Sci. 2011; 278(1709):1183-8.
34. Vívenes de Lugo M, Rodríguez-Larralde A, Castro de Guerra D. Beta-globin gene cluster haplotypes as evidence of African gene flow to the northeastern coast of Venezuela. Am J Hum Biol. 2003; 15:29-37.
35. Diez-Ewald M, Torres-Guerra E, Leets I, Layrisse M, Vizcaíno G, Arteaga M. Anemia en poblaciones indígenas del Occidente Venezolano. Invest Clín. 1999; 40 (3):191-202.
36. Hidalgo G. Vitamina A, anemia y antropometría nutricional en pre-escolares y escolares Piaroa, Estado Amazonas. (Vitamin A, anemia and nutritional anthropometrics in Piaroa preschoolers and scholars, Amazonas State) [Trabajo de grado Maestría en Nutrición]. Caracas: Universidad Simón Bolívar; 2002.
37. Zafanello M, Rugolotto S, Zamboni G, Gaudino R, Tato L. Neonatal screening for glucose-6-phosphate dehydrogenase deficiency fails to detect heterozygote females. Eur J Epidemiol. 2004; 19:255-57.
38. Monteiro W, Val F, Siqueira A, Franca G, Sampaio V, Melo G, et al.G6PD deficiency in Latin America: systematic review on prevalence and variants. Mem Inst Oswaldo Cruz. 2014; 109:553–68.
39. Beutler E. G6PD deficiency. Blood 1994; 84(11):3613-36.
40. Wang X, Lam V, Engel P. Marked decrease in specific activity contributes to disease phenotype in two human glucose 6-phosphate dehydrogenase mutants, G6PD (Union) and G6PD (Andalus). Hum Mutat. 2005; 26(3):284.
41. Castro de Guerra D, Arvelo H, Rodríguez-Larralde A, Salzano F. Genetic study in Panaquire, a Venezuelan population. Hum Hered. 1996; 46(6):323-8.
42. Castro de Guerra D, Zambrano O. Aporte génico español canario en tres poblaciones semiaisladas venezolanas. Estimaciones hechas a partir de los sistemas ABO, RH y Alfa-1-Antitripsina. Rev Esp Antropol Biol. 2000; 21: 111-8.
43. Rodríguez-Larralde A, Castro de Guerra D, González Coira M, Morales J. Frecuencia génica y porcentaje de mezcla en diferentes áreas geográ- ficas de Venezuela, de acuerdo a los grupos Rh y ABO. Interciencia. 2000; 26(1):8-12.
44. Vívenes de Lugo M, Rodríguez-Larralde A, Castro de Guerra D. Beta-globin gene cluster haplotypes as an evidence of African gene flow to the northeastern coast of Venezuela. Am J Hum Biol. 2003; 15:29-37.
45. Sans M. Admixture studies in Latin America: From the 20th to the 21st Century. Hum Biol. 2000; 72(1): 155-77.
46. Martínez H, Rodríguez-Larralde A, Izaguirre MH, Castro de Guerra D. Admixture estimates for Caracas, Venezuela, based on autosomal, Ychromosome and mtDNA markers. Hum Biol. 2007; 79(2):201-13.
47. Castro de Guerra D, Suarez M. Sobre el proceso de mestizaje en Venezuela. Interciencia. 2010; 35(9):654-8.
Para citar este artículo: Bastidas-Pacheco GA, Hidalgo-Rojas M, Colman-Álvarez L, Peña-Toro M, Quintero-Reyes MA, Pérez-Carvajal HA. Glucosa 6 fosfato deshidrogenasa en Indígenas Piaroas en zona endémica de malaria. Duazary. 2017 enero; 14 (1): 54 - 60
Recibido en abril 13 de 2016
Aceptado en mayo 25 de 2016